Un hydrocarbure est dit acyclique lorsque sa formule développée reste une chaîne ouverte c’est-à-dire non un cycle
Dans ce cadre, on peut distinguer :
• Les hydrocarbures linéaires, où chaque atome de carbone n'est lié qu'à deux autres atomes de carbone au plus ( le butane)
• Les hydrocarbures ramifiés, où un ou plusieurs atomes de carbone sont liés à plus de deux autres atomes de carbone (isooctane) ;
II.1 La nomenclature des hydrocarbures linéaires
II.1.1 Les hydrocarbures saturés
Les hydrocarbures saturés sont ceux qui ne contiennent que des atomes de carbone et d'hydrogène, reliés par des liaisons simples.
Exemple : les alcanes
a) Alcanes non ramifiés (linéaires)
Les noms des hydrocarbures sont fondamentaux. La racine de ces noms servant de nombreuses fois dans ceux d’autres classes de composés. Quel que soit le dérivé, la racine du nom sera celle de l’alcane ayant le même nombre d’atomes de carbone.
Le nom des hydrocarbures saturés est composé d’un préfixe indiquant le nombre d’atomes de carbone, à l’exception des quatre premiers, suivi de la terminaison « ane »
• De 1 à 4 carbones : préfixe historique + suffixe –ane
• Plus de 5 carbones : racine numérique + suffixe –ane
| Nb de carbone | Radical | Nom fondamental | Nom du substituant |
| 1 | Méth- | Méthane | Méthyle |
| 2 | Eth- | Éthane | Éthyle |
| 3 | Prop- | Propane | Propyle |
| 4 | But- | Butane | Butyle |
| 5 | Pent- | Pentane | Pentyle |
| 6 | Hex- | Hexane | Hexyle |
| 7 | Hept- | Heptane | Heptyle |
| 8 | Oct- | Octane | Octyle |
| 9 | Non- | Nonane | Nonyle |
| 10 | Déc- | Décane | Décyle |
| 11 | Undéc- | undécane | Undécyle |
| 12 | Dodéc | Dodécane | Dodécyle |
| 13 | Tridéc- | Tridécane | Tridécyle |
| 14 | Tetradéc- | Tetradécane | Tetradécyle |
| 15 | Pentadéc- | Pentadécane | Pentadécyle |
| 16 | Hexadéc- | Hexadécane | Hexadécyle |
| 17 | Heptadéc- | Heptadécane | Heptadécyle |
| 18 | Octadéc- | Octadécane | Octadécyle |
| 19 | Nonadéc- | Nonadécane | Nonadécyle |
| 20 | Eicos- | Eicosane | Eicosyle |
| 21 | heneicos- | heneicosane | heneicosyle |
| 22 | docos- | docosane | docosyle |
| 23 | tricos- | tricoane | tricosyle |
| 24 | tétracos- | tétracosane | tétracosyle |
| 30 | Triacontane | Triacontane | Triacontyle |
| 31 | hentriacont- | hentriacontane | hentriacontyle |
| 32 | dotriacont- | dotriacontane | dotriacontyle |
| 100 | hect- | Hectane | hectyle |
b) Alcanes ramifiés
Un alcane ramifié est constitué d’une chaîne principale et de substituants
Alcanes ramifiés = chaîne la plus longue + substituant alkyle
Les groupements hydrocarbonés ou radicaux de symbole \(R\) que l’on désigne par le terme alkyle ou alcoyle, sont des fragments dérivant d’alcanes lorsqu’ils sont univalents, fixés sur une chaîne plus importante. Ils sont obtenus en retranchant formellement un hydrogène aux alcanes et sont dénommés en remplaçant le suffixe « ane » par « yle ».
Exemple :
• Pour le méthane \(C{H_4}\), on a le radical méthyle \(C{H_3} - \),
• Pour l’éthane \(C{H_3} - C{H_3}\) on a le radical éthyle \(C{H_3} - C{H_2} - \)
Les chaînes latérales sont numérotées à partir du carbone lié à la chaîne principale.
Si nécessaire, le nom de la chaîne secondaire est mis entre parenthèses.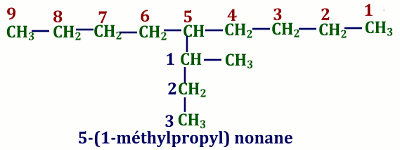 Chaîne principale : nonane
Chaîne principale : nonane
Indice de substitution principal : 5
Nom du radical ramifié : 5-propyl
Nom de la ramification secondaire : 1-méthyl
• Un radical est dit simple lorsqu’il n’est pas ramifié, il sera dit complexe lorsqu’il a des ramifications.
• Les termes iso, sec, tertio, cyclo…etc ; entrent dans l’ordre alphabétique.
• Les radicaux complexes sont écrits entre parenthèses, dans ce cas, on tient compte du préfixe multiplicateur (di, tri…) dans le classement par ordre alphabétique.
II.1.2 Les hydrocarbures non-saturés (insaturés)
Les hydrocarbures insaturés, sont ceux dont la chaîne carbonée présente au moins une liaison double ou triple
• Les alcènes ;
• Les alcynes ;
• Les hydrocarbures aromatiques.
a) Les alcènes
Ils comportent une ou plusieurs doubles liaisons \(C = C\). La double liaison est le groupement fonctionnel.
• la chaîne principale sera la plus longue chaîne contenant la double liaison.
Cette double liaison aura le plus petit indice possible.
• Le nom de l’alcène est obtenu à partir de celui de l’alcane ayant le même nombre d’atomes de carbone en remplaçant la terminaison « ane » par la terminaison « ène ».
• lorsqu’il y a plusieurs doubles liaisons, on choisit la chaîne qui renferme le maximum de doubles liaisons, c’est un polyène : radical-n,n'-diène, radical-n,n',n"-triène…
• Préciser la stéréochimie Z ou E de la double liaison s’il a lieu.
On dit éthylène au lieu de éthène pour \(C{H_2} = C{H_2}\)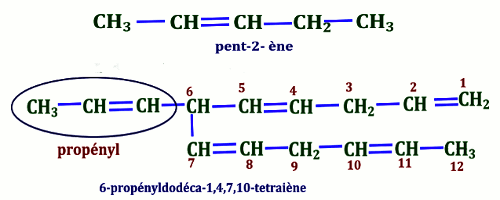
NB : Dans le cas des composés insaturés, la chaîne principale n’est pas forcément la plus longue mais celle qui contient le plus d’insaturations.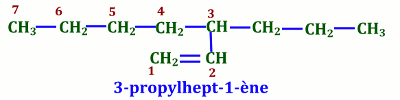 Groupements dérivés des alcènes (Terminaison : ényle (ényl dans le nom))
Groupements dérivés des alcènes (Terminaison : ényle (ényl dans le nom))
Lorsqu’un groupement possède une double liaison, le nom de ce groupement se termine par « ényle » précédé du numéro de l’atome de carbone de la chaîne principale.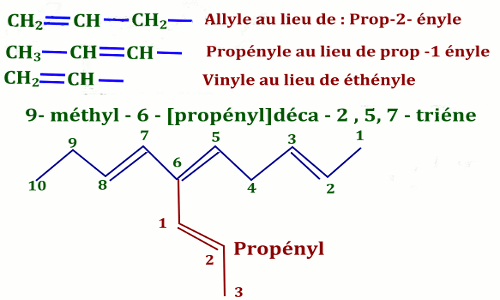
b) Alcynes
Ils comportent une ou plusieurs triples liaisons \(C = C\) ; leur nomenclature est identique à celle des alcènes mais la terminologie sera « yne » au lieu de « ène ».
Exception : acétylène au lieu de éthyne pour \(H - C \equiv C - H\)
Groupements dérivant des alcynes
Les groupements dérivés des alcynes ont leur terminaison en ynyle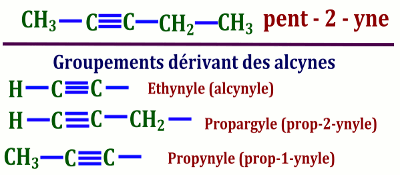
c) Hydrocarbure comportant à la fois des doubles liaisons et des triples liaisons
La terminaison est ényne.
Lorsqu’une molécule renferme à la fois une double et une triple liaison, celles-ci sont traitées à égalité sauf si les indices sont les mêmes dans les deux sens, auquel cas c’est la double liaison qui est prioritaire sur la triple pour le sens de la numérotation ou pour faire partie de la chaîne principale (dans ce cas, la triple liaison devient substituant).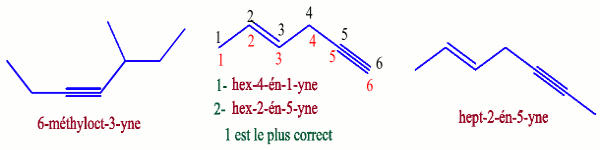
d) Hydrocarbures monocycliques aromatiques
D’après la règle de Hückel
Une molécule est dite aromatique, lorsqu’elle :
• Possède une structure plane, cyclique et \(4n + 2\) électrons délocalisées (\(n\) un nombre entier)
• Est insaturée et entièrement conjuguée.
En première approximation, un composée aromatique est un composé cycliques possédant des doubles liaisons \(C = C\) en alternance régulière avec des liaisons simples \(C-C\).
Un trait représentant une double liaison a à ses extrémités deux électrons délocalisés appelés électrons \(\pi \), ainsi le benzène a 6 électrons \(\pi \) soit \(6 = 4n + 2\) \( \Rightarrow n = 1\)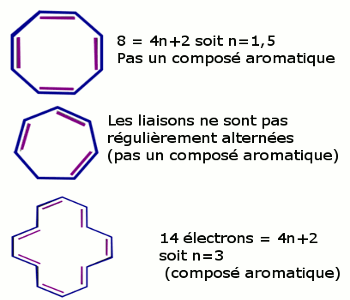 La plupart des hydrocarbures monocycliques aromatiques ont un nom non-systématique :
La plupart des hydrocarbures monocycliques aromatiques ont un nom non-systématique :
• La substitution est indiquée par des nombres.
• Les substituants ont les indices les plus bas possibles. Si un choix subsiste, on prend l’ordre alphabétique.
Le benzène \({C_6}{H_6}\) est le plus simple des hydrocarbures benzéniques. Le substituant dérivé du benzène est appelé :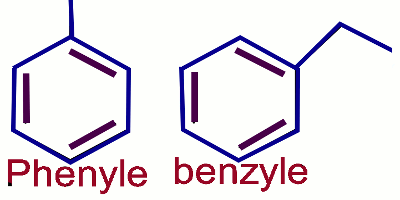
1) Benzènes monosubstitués
La chaîne principale sera ici le benzène. Le nom du composé sera formé du nom du groupement suivi du mot benzène. Mais la plupart ont des noms usuels.
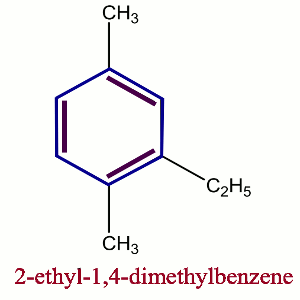
2) Benzènes di substitués
Les benzènes di substitués peuvent exister sous trois isomères, qui seront localisés soient par les chiffres (1,2); (1,3); (1,4) soient respectivement par ortho (o), méta (m), para (p).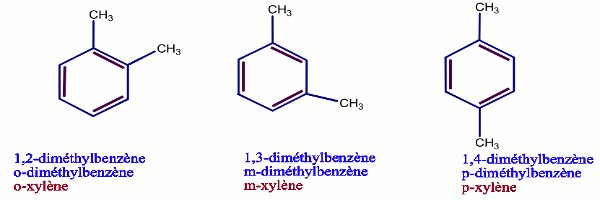
3) Benzènes poly substitués
Dans ce cas seulement on numérotera de telle façon que l’ensemble des indices obtenus pour les constituants soit le plus bas possible, et faisant précéder le mot benzène des préfixes et indices correspondant aux substituants