Partie A : Évaluation des ressources / 24 pts
Exercice 1 : Vérifications des savoirs/ 8pts
1- Définissons :
Point d’équivalence : C’est le point où les réactifs sont mélangés dans les proportions stœchiométriques au cours de la réaction de dosage. 0,5pt
Mélange racémique : C’est un mélange équimolaire de deux énantiomères. 0,5pt
1-2. QCM : Choisissons la bonne réponse parmi celles proposées ci-dessous : 4x0,5pt
1/b ;
2/b ;
3/a ;
4/c
1-3. Donnons un exemple de réaction lente (avec son équation-bilan) 1 pt
\({H_2}{O_2} + 2{I^ - } + 2{H_2}O\) \( \to 4{H_2}O + {I_2}\)
1-4. Identification : l’acide faible le plus fort est \({C_6}{H_5}COOH\) et la base faible la plus forte est \(N{H_3}\) car plus le \(Ka\) est grand (\(pKa\) faible) plus l’acide est fort (plus sa base conjuguée est faible). 2x0,5 pt
1-5. Répondons par vrai ou faux :
1/ Vrai ;
2/Faux (pyramide à base triangulaire) ;
3/Vrai ;
4/Vrai
Exercice 2 : Applications des savoirs / 8pts
2-1. Écrivons les formules des acides \(\alpha \)-aminés suivants en notant le (ou les) carbone (s) asymétrique (s) par un astérisque (*).
a) Acide 2-amino-3-méthylpentanoïque 1pt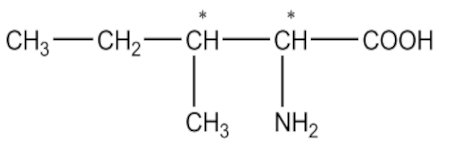 b) Acide 2-amino-3-hydroxybutanoïque 1pt
b) Acide 2-amino-3-hydroxybutanoïque 1pt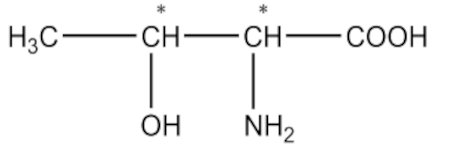 2-2. Nommons les composés suivants selon l’UIPAC.
2-2. Nommons les composés suivants selon l’UIPAC.
a) Anhydride éthanoïque propanoïque 1pt
b) N-phénylpropanamide 1pt
2-3. Indiquons pour chacune des réactions suivantes, la formule semi-développée des composés représentés par des lettres : 8x0,5 pt
A) \(C{H_3} - OH\)
B) \(HCl\)
C) \({C_6}{H_5}COCl\)
D) \(NaOH\)
E) \(C{H_3} - COOC{H_2} - C{H_3}\)
F) \(C{H_3} - CON(C{H_3})C{H_2}C{H_3}\)
G) \(HCl\)
H) \(C{H_3} - C{H_2} - CO - O - \) \(CO - C{H_2} - C{H_3}\)
Exercice 3 : Utilisation des savoirs
3-1- Écrivons l'équation chimique de la réaction d'oxydoréduction qui modélise l'oxydation des ions iodure par l'eau oxygénée : 1 pt
\({H_2}{O_2} + 2{I^ - } + 2{H_3}{O^ + }\) \( \to 4{H_2}O + {I_2}\)
3-2- Écrivons l'équation chimique de la réaction d'oxydoréduction au cours de laquelle le diiode formé est réduit en ion iodure : 1 pt
\(2{S_2}O_3^{2 - } + {I_2} \to \) \({S_4}O_6^{2 - } + 2{I^ - }\)
Cette réaction s’effectue en milieu acide et le diiode est un ampholyte 0,5 pt
3-3- On peut détecter l'équivalence, au cours de ce dosage par le changement de coloration. 1pt
3-4-a) Calculons la vitesse moyenne de la réaction entre les instants \({t_1} = 2min\) et \({t_2} = 10min\):
\(Vm({H_2}{O_2}) = - \frac{{{n_2} - {n_1}}}{{{t_2} - {t_1}}}\)
AN : \(Vm({H_2}{O_2}) = 0,75\) mmol/min
b) Déduisons graphiquement l'instant \({t_0} \) pour lequel la vitesse instantanée de la réaction est égale à la vitesse moyenne précédemment calculée : \({t_0} = 5min\) et comparons à \(\frac{{{t_1} - {t_2}}}{2} = \) \(\frac{{2 + 10}}{2} = 6\min \)
Donc \({t_0} \prec \frac{{{t_1} - {t_2}}}{2}\)
c) Déterminons le volume de la solution de thiosulfate de potassium nécessaire pour doser la quantité de diiode formé à l'instant \({t_1} \).
A \(t = {t_1} = 5\min \) , \({n_{res\tan t}}({H_2}{O_2}) = \) \(12mmol = 1,2 \times {10^{ - 2}}mol\) alors \({n_{reagit}}({H_2}{O_2}) = 1,8 \times {10^{ - 2}}mol\) \( - 1,6 \times {10^{ - 2}}mol = \) \(0,6 \times {10^{ - 2}}mol\)
\({n_{{H_2}{O_2}}} = \frac{{{n_{{I^ - }}}}}{2} \Rightarrow {n_{{I^ - }}}\) \( = 2{n_{{H_2}{O_2}}}(reagit) = \) \(1,2 \times {10^{ - 2}}mol\)
\({n_{{S_2}O_3^{2 - }}} = {n_{{I^ - }}} = 1,2 \times {10^{ - 2}}mol\)
\({n_{{S_2}O_3^{2 - }}} = CV \Rightarrow V\) \( = \frac{{{n_{{S_2}O_3^{2 - }}}}}{C} = 0,05L\)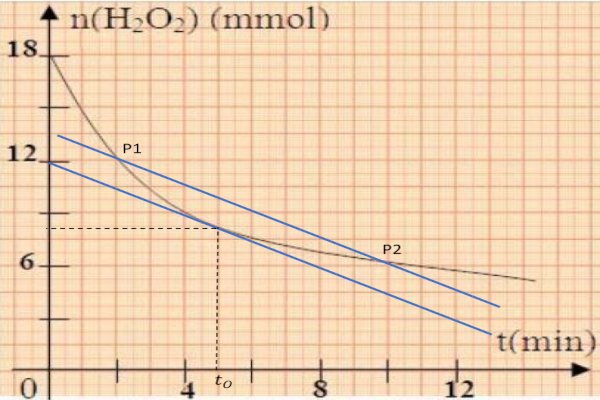
PARTIE B : EVALUATION DES COMPETENCES / 16points
1-Proposons un protocole expérimental permettant d’établir le tableau :
Il est question pour nous ici de décrire le mode opératoire d’un dosage pH-métrique qui é permis de d’établir le tableau des mesures. Pour cela nous allons suivre la démarche suivante :
• Préparer un volume V=500 mL de la solution S de vitamine \({B_9}\);
• Réaliser le montage du dispositif expérimental ci-dessous ;
• Prélever à l’aide d’une pipette jaugée un volume VA =20 mL de la solution S puis l’introduire dans le bécher
• Introduire la solution d’hydroxyde de sodium dans la burette graduée en prenant soin de fermer le robinet
• Immerger les électrodes du pH-mètre dans la solution du bécher et noter la valeur initiale du pH
• Ajouter, à des intervalles de temps donné, un volume VB de la solution de la burette dans la solution du bécher en prenant soin de mettre l’agitateur magnétique en marche ;
• Noter pour chaque volume VB ajouté, la valeur indiquée par le pH-mètre.
C’est en procédant ainsi, qu’on a obtenu les résultats du tableau donné. 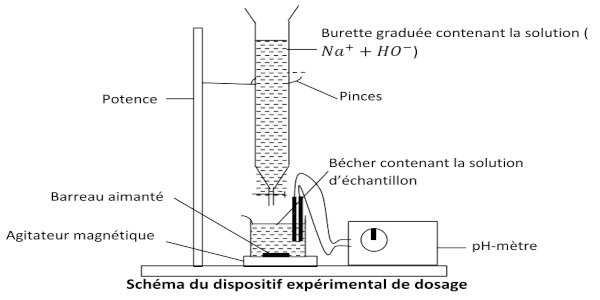 2- Prononçons-nous sur la qualité du médicament :
2- Prononçons-nous sur la qualité du médicament :
Interprétation :
Il est question pour nous ici de chercher le principe actif du médicament étudié et ensuite se prononcer sur la qualité du médicament. Pour cela, nous allons suivre les étapes suivantes :
• Tracer le graphe \(pH=f(V B )\) ;
• Exploiter la courbe obtenue pour déterminer le pKa du principe actif contenu dans le médicament
• Comparer le pKa trouvé avec ceux donnés dans le document 3 et en déduire la nature du principe actif ;
Si le principe actif est l’acide folique, vérifier qu’un comprimé contient 5mg de cet acide avant de conclure sur la qualité du médicament ;
-Conclusion : Me prononcer sur la qualité du médicament.
Graphe de la relation \(pH)=f(VB )\)
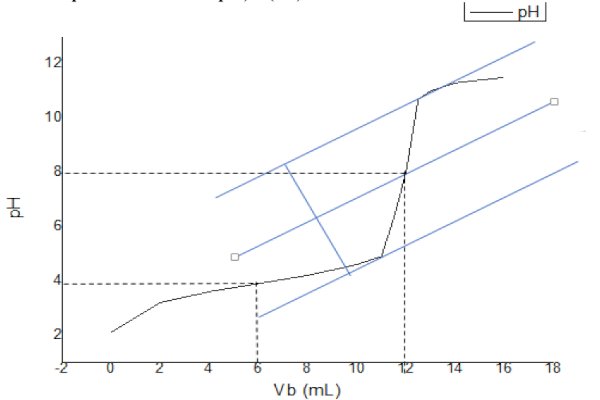 L’exploitation de cette nous permet de déterminer les coordonnées des points d’équivalence
L’exploitation de cette nous permet de déterminer les coordonnées des points d’équivalence
et de demi équivalence suivants : {? ?? = 12?? ?? ? = 8 et { ???2 = 6??
\(\left\{ \begin{array}{l}{V_{BE}} = 12mL\\p{H_E} = 8\end{array} \right.\) et \(\left\{ \begin{array}{l}\frac{{{V_{BE}}}}{2} = 6mL\\p{H_a} = 4\end{array} \right.\)
Ainsi le pKa du principe actif contenu dans le médicament étudié vaut \(pKa= 4\)
Comparaison : D’après le document 3 nous avons :
• Acide folique : \(Ka = 1,26 \times {10^{ - 4}} \Rightarrow \) soit \(pKa = 3,9\)
• Acide éthanoïque : \(Ka = 1,78 \times {10^{ - 5}} \Rightarrow \) \(pKa = 4,75\)
Nous constatons que le \(pKa\) du principe actif contenu dans le médicament étudié est plus proche de celui de l’acide folique ;
• Calcul de la masse d’acide folique contenu dans un comprimé de ce médicament
Pour 20mL de solution prélevée on a : \(\frac{{{m_{AF}}}}{M} = {C_A} \times {V_A} \Rightarrow \) \({m_{AF}} = {C_A} \times {V_A}M\)
?? : \({m_{AF}} = 1,2 \times {10^{ - 4}}g\)
???? un ???????é (??????? ???? 500? ?) ?? ?: \({m_{AF}} = \frac{{500}}{{20}} \times 1,2 \times {10^{ - 4}}\) \( = 0,03g\)
Nous constatons qu’un comprimé de ce médicament ne contient que 3mg de principe actif au lieu 5mg
Conclusion :
L’exploitation des résultats de l’expérience a montré que c’est l’acide folique qui est principe actif de la vitamine \({B_9}\) saisie par la douane mais la quantité du principe actif de cette vitamine n’est pas suffisante : La vitamine \({B_9}\) saisie est donc un mauvais médicament.


