Masses molaires atomiques (g/mol) : C : 12 ; H : 1 ; N : 14 ; O : 16 ; Cl : 35.5
PARTIE A : ÉVALUATION DES RESSOURCES /24pts
Exercice 1 : Vérification des savoirs / 8pts
1- Définir : solution tampon ; mélange racémique 1x2=2pts
2- Donner l’expression du pH à 25°C d’une solution de monobase forte en fonction de sa concentration Cb . 1pt
3- Répondre par vrai ou faux 0.5x4=2pts
3-1- La réaction entre un acide fort et une base forte est totale et exothermique
3-2- Un acide est d’autant plus fort de la constante d’acidité du couple auquel il appartient est petit
3-3-Dans une solution d’acide α-aminé, en milieu acide, l’anion est la forme prédominante
3-4- La liaison peptidique a une fonction amine.
4- Nommer les composés suivants : 1x2=2pts  5- Compléter sans les recopier les phrases suivantes : 0.5x2= 1pt
5- Compléter sans les recopier les phrases suivantes : 0.5x2= 1pt
5-1- L’action d’une amine sur un chlorure d’acyle conduit à un …(a)…
5-2- Des isomères de chaîne ont des propriétés …(b)… différentes
Exercice 2 : Application des savoirs / 8pts
La mesure du pH d’une solution décimolaire de chlorure d’ammonium (\(NH_4^ + + C{l^ - }\)) donne 5,1.
1- Quelle masse de chlorure d’ammonium solide a-t-il fallu dissoudre dans 250 cm3 d’eau pour obtenir cette solution ? 1pt
2- Montrer que le chlorure d’ammonium est un acide faible et en déduire l’équation de la réaction entre l’ion ammonium et l’eau 2pts
3- Calculer les concentrations molaires des différentes espèces présentes en solution 2.5pts
4- Calculer le pourcentage d’ions ammonium transformés en ammoniac 1pt
6- Exprimer puis calculer la constante d’acidité du couple \(NH_4^ + /N{H_3}\) 1.5pt
Exercice 3 : Utilisation des savoirs / 8pts
A- Afin d’étalonner un pH-mètre lors d’une séance de T.P, des élèves de terminale scientifique ont besoin d’une solution tampon de pH = 4.8 à 25°C. L’enseignant de chimie leur demande alors de préparer 500 cm 3 de cette solution et met à leur disposition les solutions ci-dessous :
Solution S1 : Ethylamine C1 =10 -2 mol/L
Solution S2 : Ethanoate de sodium C2 =10 -2 mol/L
Solution S 3 : Acide chlorhydrique C3 =10 -1 mol/L
Solution S4 : Soude C 4 =10 -1 mol/L
Données : Valeurs de pKa
Ion éthylammonium/thylamine : 10.2
Acide éthanoique/ion éthanoate : 4.8
1- Indique leur en te justifiant, quelles solutions choisir pour la préparation souhaitée. 1pt
2- Détermine le volume de chaque solution à prélever pour obtenir la solution tampon désirée. 3pts
B- On veut étudier la cinétique de la réaction entre les ions thiosulfate ( \({S_2}O_3^{2 - }\) ) et l'acide chlorhydrique.
Pour cela, on verse 10 mL de solution d'acide chlorhydrique de concentration C=5mol.L-1 dans 40 mL d'une solution de thiosulfate de sodium de concentration C’ = 0,5 mol/L. Il se dégage du dioxyde de soufre, et le mélange blanchit progressivement par formation du soufre solide.
B-1- Écrire l’équation-bilan de la réaction 1pt
B-2 L'étude de l'évolution de la formation du soufre en fonction du temps conduit à la courbe ci-dessous, où ns représente la quantité de matière de soufre formé.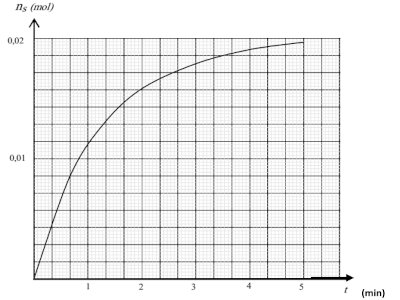 B-2-1 Quelle est la valeur limite de ns ? Déterminer le réactif en excès ? 1pt
B-2-1 Quelle est la valeur limite de ns ? Déterminer le réactif en excès ? 1pt
B-2-2 Déterminer la vitesse moyenne de formation du soufre entre les instants t0 =0 et t1 =2min. 1pt
B-2-3 Déterminer la vitesse instantanée de formation du soufre à la date t =2 min. 1pt
Partie B : Évaluation des compétences/ 16pts
Au cours d'une séance de travaux pratiques, deux camarades de classe, Oumar et Farikonsou constatent que sur la paillasse du laboratoire, se trouve un flacon d'une solution S1 d’acide pur dont le nom et la concentration Ca sont devenus illisibles. Ils font alors les propositions suivantes pour le nom cet acide- Oumar : Acide méthanoïque - Faikonsou : Acide propanoique
Pour les départager, le professeur repartit les élèves en deux groupes et leur donne les tâches suivantes :
- 1er groupe : Préparer 100 mL d'une solution S2 de cet acide diluée 100 fois.
- 2nde groupe : Réaliser le dosage pH-métrique de 20 cm3 de S2 par une solution d'hydroxyde de sodium de concentration Cb =10 -1 mol/L. Ils obtiennent les résultats suivants où V représente le volume de soude versé :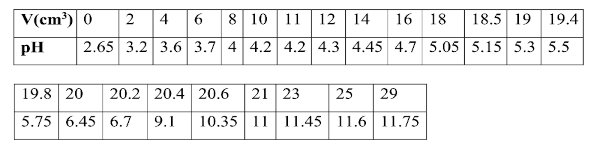 - 3e groupe : Exploiter les résultats obtenus par le 2e groupe pour départager les deux camarades ‘parieurs’ et déterminer la concentration de S1 .
- 3e groupe : Exploiter les résultats obtenus par le 2e groupe pour départager les deux camarades ‘parieurs’ et déterminer la concentration de S1 .
A l’aide de tes connaissances et d’une démarche logique et scientifique :
1- Indique clairement au 1er groupe comment procéder pour obtenir S2 4pt
2- Indique clairement à tes camarades n’appartenant pas au 2e groupe, comment a été obtenu le tableau des valeurs 4pts
3- Aide tes camarades du 3e groupe à réaliser la tâche qui leur a été assignée 8pts


