PARTIE 1 : ÉVALUATION DES RESSOURCES 24 POINTS
EXERCICE 1 : VÉRIFICATION DES SAVOIRS 8Pt
1. Définir : 2ptx2
Oxydation : réaction au cour de laquelle une espèce chimique perd des électrons.
Monobase forte : composé qui réagit totalement avec l’eau en fixant un proton.
2 b) Une solution tampon 1 pt
3 c) pH ˂ 7 1 pt
4 vrai 1pt
5 faux 1pt
EXERCICE 2 : APPLICATION DES SAVOIRS 8pt
1 a) Acide 2-méthylpentanoique : \(C{H_3} - C{H_2} - C{H_2} - \) \(CH(C{H_3}) - COOH\) 2 pt
b) 2,2-diméthylhexan-3-ol : \(C{H_3} - C{H_2} - C{H_2}\) \( - CH(OH) - C{(C{H_3})_2}\) 2 pt
2 \(C{H_3} - CH(OH) - C{H_3}\) : propan-2-ol 1pt
\(C{H_3} - C{H_2} - C{H_2} - OH\) : propan-1-ol 1pt
3. Hors programme.
EXERCICE 3 : UTILISATION DES SAVOIRS : 8 pt
1 Le métal qui occupe le pole positif de cette pile est le cuivre (Cu) 1pt
2 Schéma de la pile : 2pt 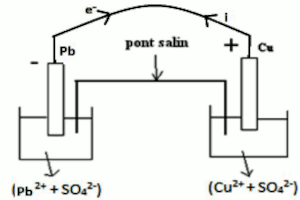 3 Représentation conventionnelle de cette pile : \( \odot Pb/P{b^{2 + }}\) \(//C{u^{2 + }}/Cu \oplus \) 1pt
3 Représentation conventionnelle de cette pile : \( \odot Pb/P{b^{2 + }}\) \(//C{u^{2 + }}/Cu \oplus \) 1pt
4. Écrivons l’équation-bilan de fonctionnement de cette pile. 1 pt
\(C{u^{2 + }} + Pb \to \) \(P{b^{2 + }} + Cu\)
5. Précisons le réducteur et l’oxydant. 0,5ptx2= 1pt
Oxydant : \(C{u^{2 + }}\)
Réducteur : Pb
6. Calculons la f.é.m. de cette pile. 2pts
\({E^o}\left( {P{b^{2 + }}/Pb} \right) = - 0,13V\)
\({E^o}\left( {C{u^{2 + }}/Cu} \right) = 0,34V\)
\(E = {E^o}\left( {C{u^{2 + }}/Cu} \right) - \) \({E^o}\left( {P{b^{2 + }}/Pb} \right) = 0,34\) \( + 0,13 = 0,47V\)
PARTIE 2 : ÉVALUATION DES COMPÉTENCES 16 Pt
1. Problème scientifique : donner le protocole du dosage pH-métrique 2 pt
• Démarche à suivre:
• Faire le schema du dispositif expérimental.
• Donner le mode opératoire.
• Résolution
• Dispositif expérimental 2 pt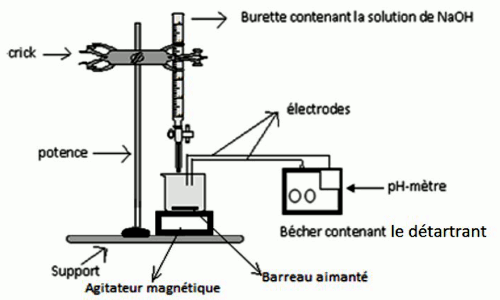 • Mode opératoire.
• Mode opératoire.
Prélever 0,26 g de détartrant l’introduire dans le bécher et la dissoudre totalement avec de l’eau distillée.
Introduire les électrodes du pH-mètre dans le bécher.
Remplir la burette avec la solution d’hydroxyde de sodium
Verser de petites quantités de base dans le bécher et noter à chaque fois la valeur du pH de la solution, et compiler tous les résultats obtenus dans un tableau.
2 : Dire si l’information marquée sur le sachet de détartrant est fiable.
Problème scientifique : Déterminer le pourcentage d’acide sulfonique contenu dans le détartrant.
Démarche à suivre:
Écrire l’équation bilan de la réaction ayant lieu.
Exploiter la courbe à fin de déterminer les coordonnées du point d’équivalence. 1 pt
Calculer la masse d’acide contenu dans l’échantillon dosé et en déduire son pourcentage.
Comparer.
Résolution:
Équation bilan de la réaction ayant lieu : 1pt
\(AH + H{O^ - } \to \) \({A^ - } + {H_2}O\)
Déterminer les coordonnées du point d’équivalence. 1 PT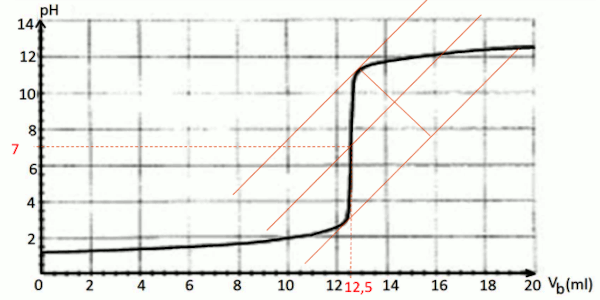 E (12,5ml ; 7) 0,5 pt
E (12,5ml ; 7) 0,5 pt
Calculons la masse d’acide contenu dans l’échantillon dosé. 1 pt
\({n_a} = {n_b} \Leftrightarrow {m_a}\) \( = {C_b}{V_{bE}}{M_a}\)
\({m_a} = 0,2425\)g
Déduire son pourcentage
\(\% AH = \frac{{{m_a}}}{m} = 0,93\)
Comparer. \(93\% \succ 80\% \) 05 pt
Conclusion : l’information marquée sur la boite n’est pas fiable. 1pt


