Partie A : Évaluation des ressources / 24 points
Exercice 1 : Vérification des savoirs / 8 points
1. Définition :
a) Polymérisation : Réaction d’addition de plusieurs molécules insaturées identiques. 0,5 pt
b) Couple oxydant/réducteur : Ensemble de deux espèces chimique conjuguées dont l’une est obtenue à partir de l’autre par transfert d’électrons 0,5 pt
2.Choisir la bonne réponse : 0,5 x 2 = 1 pt
a) iii
b) i
\(2{S_2}O_3^{2 - } + {I_2}\) \( \to 2{I^ - } + {S_4}O_6^{2 - }\)
5 .Il s’agit d’une réaction d’oxydoréduction car il y a variation du nombre d’oxydation . 0,5 pt
L’oxydant est : \({I_2}\) (le diiode) 0,5 pt
Le réducteur est : \({S_2}O_3^{2 - }\) (l’ion thiosulfate) 0,5 pt
6 . Nommons les composés :
A :2,3-diméthyl-3-phéylpentane 0,5 pt
B :4,4-diméthylhex-2-yne 0,5 pt
C :1-éthyl-3,5-diméthylbenzène 0,5 pt
7. Deux méthodes de protection du fer : 1 x 2 = 2 pts
• -Protection par revêtement métallique
• Protection par revêtement non-métallique
• -protection par inhibition
• -protection anodique ou cathodique
Exercice 2 : Application des savoirs / 8 points
1.a) Il ne se produit aucune réaction car l’argent est moins réducteur que le plomb ou encore l’ion plomb est moins oxydant que l’ion argent.
b) i) Le pôle positif : électrode d’argent 0,5 pt
Le pôle négatif : électrode de plomb 0,5 pt
ii) Écrire l’équation bilan de la réaction
\(2A{g^ + } + Pb \to \) \(2Ag + P{b^{2 + }}\)
iii) Calcul e la force électromotrice. 1,5 pt
\({E^o} = {E^o}(A{g^ + }/Ag)\) \( - {E^o}(P{b^{2 + }}/Pb)\)
AN : \({E^o} = = 0,8 - ( - 0,13)\) \( = 0,93V\)
2-a) Équation de polymérisation : 1 pt
\(nFHC = FHC\) \( \to {\left( { - FHC - FHC - } \right)_n}\)
b) Représentation du motif du polymère : \({ - FHC - FHC - }\) 0,5 pt
c) déterminons le degré de polymérisation : 1,5 pt
\(n = \frac{{{M_P}}}{{{M_m}}} = \) \(\frac{{84900}}{{64}} = 13280\)
Exercice 3 : Utilisation des savoirs / 8 points
1) Utilisons le \(n.o\) pour équilibrer l’équation 0,25 x 2 = 0,5 pt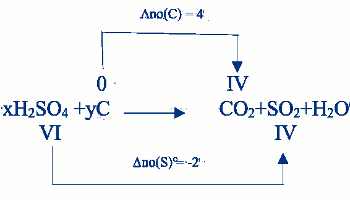 Comme c’est une équation d’oxydo-réduction, déterminons x et y :
Comme c’est une équation d’oxydo-réduction, déterminons x et y :
\( - 2x + 4y = \) \(0 \Rightarrow \left| \begin{array}{l} x = 2\\ y = 1 \end{array} \right.\)
d’où l’équation bilan équilibrée : 1 pt
\(2{H_2}S{O_4} + C\) \( \to C{O_2} + 2S{O_2}\) \( + 2{H_2}O\)
2)a Équation bilan du dosage : 1 pt
\(MnO_4^ - + 8{H_2}{O^ + }\) \( + 5{e^ - } \to M{n^{2 + }}\) \( + 12{H_2}O\)
\(S{O_2} + 6{H_2}O \to \) \(SO_4^{2 - } + 4{H_3}{O^ + }\) \( + 2{e^ - }\)
\(2MnO_4^ - + 5S{O_2}\) \( + 6{H_2}O \to 2M{n^{2 + }}\) \( + 5SO_4^{2 - } + 4{H_3}{O^ + }\)
NB : Ces équations sont réversibles.
b-Déterminons la concentration de la solution Cr : 1,5 pt
\({n_r} = \frac{5}{2}{n_o} \Rightarrow \) \(Cr = \frac{{5CoVo}}{{2Vr}}\)
AN : \(Cr = 0,15mol/L\)
3) a- Déterminons la composition centésimale 0,5 x 2 = 1 pt
\({m_C} = \frac{3}{{11}}{m_{C{O_2}}}\) \( = 0,794g\)
\(\% C = \frac{{{m_C}}}{{{m_B}}} \times \) \(100 = 90,7\% \)
\(\% H = 100\) \( - \% C = 9,3\% \)
b) Déterminons la formule brute : soit \(CxHy\) 1,5 pt
\(\% C = \frac{{x{M_C}}}{{29d}}\) \( \Rightarrow x = 8\)
\(y = \frac{{\% H.29d}}{{100 \times {M_H}}}\) \( = 10\)
la formule brute \({C_8}{H_{10}}\)
c) Donnons les différentes formules semi développées 1,5 pt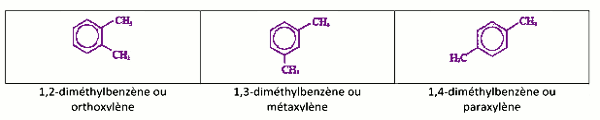
Partie B : Évaluation des compétences /16 points
1. Proposer un protocole expérimental permettant de réaliser la réaction (3) :
Matériels et produits nécessaires :
• Échantillon de sang prélevé (12ml)
• Liqueur de Fehling
• Seringue graduée
• Tube à essai
• Bec bensen
Mode opératoire 2,5 pt
A l’aide d’une seringue graduée, prélever 12 ml de sang du patient qu’on introduit dans un tube à essai contenant quelques centimètres cubes de liqueur de Fehling (en excès). Chauffons le mélange à l’aide d’un bec bensen ;
il apparait un précipité rouge brique d’oxyde de cuivre \(I(C{u_2}O)\).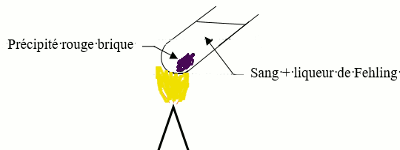 2. Se prononcer sur l’état de santé de grand-père BAKO
2. Se prononcer sur l’état de santé de grand-père BAKO
Il suffit de déterminer la quantité en masse de glucose contenue dans le sang prélevé et par la suite calculer la concentration massique du glucose dans le sang et la comparer à 180mg/l.
Déterminons la quantité en masse de glucose contenue dans le sang prélevé :
On a :
\(2C{u^{2 + }} + 2O{H^ - }\) \( + 2{e^ - } \to CuO\) \( + {H_2}O\)
\(R - CHO + 3O{H^ - }\) \( \to R - CO{O^ - } + \) \(2{H_2}O + 2{e^ - }\)
Équation bilan
\(2C{u^{2 + }} + R - CHO\) \( + 5H{O^ - } \to R - CO{O^ - }\) \( + C{u_2}O + 3{H_2}O\)
Où R-CHO est le glucose
D’après l’équation-bilan, on a :
\({n_{R - CHO}} = \) \({n_{C{u_2}O}} \Rightarrow {m_{R - CHO}}\) \( = \frac{{{m_{C{u_2}O}}}}{{{M_{C{u_2}O}}}}{M_{R - CHO}}\)
A.N : \({m_{R - CHO}} = 7,5mg\)
Concentration massique de glucose dans le sang prélevé 1,5 pt
\({C_m} = \frac{m}{V} = \) \(625mg/L\)
Comparer à celle d’une personne en santé
\(180mg/L \prec \) \(625\;mg/L\)
Conclusion : Grand-père BAKO souffre du diabète 1 pt


