Partie A : Évaluation des ressources
Exercice 1 : Vérification des savoirs
1.1 Définition :
(a) Indice de polymérisation : nombre de fois qu'on additionne un monomère pour avoir un polymère 0,5 pt
(b) Couple oxydant-réducteur : ensemble de deux espèces conjuguées dont l'une est l’oxydant et l'autre le réducteur. 0,5 pt
1.2 0,5 x6 = 3 pts
• 1.2.1 : F;
• 1.2.2 : V;
• 1.2.3 : V;
• 1.2.4 : F;
• 1.2.5 : V;
• 1.2.6 : F
1.3 Formules développées et structure de l'éthylène et du benzène :
• Formules développées : 0,5 x2 = 1 pt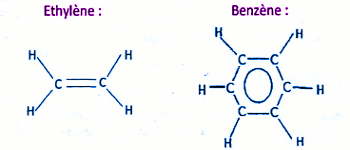 • structure : L’éthylène et le benzène ont une structure plane. 0,5 pt
• structure : L’éthylène et le benzène ont une structure plane. 0,5 pt
• Comparaison de la nature et de la longueur de la liaison carbone-carbone :
La liaison carbone-carbone dans les deux molécules est multiple. 0,25 x 2 = 0,5 pt
la longueur de la liaison C-C est de 134 om dans l'éthylène et de 140 nm dans le benzène. 0.25 x2= 0,5 pt
1.4 Explication de la solubilité des alcools dans l'eau :
C'est le fait de la formation des liaisons hydrogènes entre les molécules d'eau et d'alcools. 1 pt
Exercice 2 : Application des savoirs
Nomenclature :
2.1.1 Noms des composés :
a) 2, 2, 4- triméthylpentane 0,5 pt
b) 3-éthyl- 3, 2 - diméthylheptan-4-one 0,5 pt
2.1.2 Formule semi-développée : \(C{H_3} - CH = \) \(C\left( {C{H_3}} \right) - C{H_3}\) 1 pt
2.2.1 Équation - bilan de la polymérisation :
\(n(C{H_2} = CH\) \( - {C_6}{H_5}) \to - \) \(\underbrace {{{( - C{H_2} = CH - {C_6}{H_5} - )}_n}}_{Polymère}\) \( - \) 1 pt
Nom du polymère : polystyrène 0,5 pt
2.2.2 Degré de polymérisation \(n\) :
\(n = \frac{{{M_D}}}{{{M_C}}}\) \( = \frac{{3640}}{{104}}\) \( = 35\) 0,5 pt
2.3 Équilibrons l'équation-bilan suivante en utilisant les nombres d'oxydation t
\(x{H_2}\underbrace S_{ - II} + {H_3}{O^ + }\) \( + y\underbrace N_{ + V}O_3^ - \to \) \(\underbrace N_{ + II}O + \underbrace S_0 + \) \({H_2}O\) 1 pt
\(\Delta n.o(S) = 0\) \( - ( - II) = 2\)
\(\Delta n.o(N) = + II\) \( - ( + V) = - 3\)
\(2x - 3y = 0\) \( \Rightarrow \left\{ \begin{array}{l}x = 3\\y = 2\end{array} \right.\) 0,5 pt
Équation - bilan équilibrée :
\(3{H_2}S + 2{H_3}{O^ + }\) \( + 2NO_3^ - \to 2NO\) \( + 3S + 6{H_2}O\) 0,5 pt
2.4 Les couples mis en jeu sont : \(F{e^{2 + }}/Fe\) ; \(A{g^{2 + }}/Ag\) et \({H_3}{O^ + }/{H_2}\) 0,25 x 3 = 0,75 pt
Dans le bécher A : il y a réaction entre \(Fe\) et \({H_3}{O^ + }\), donc \(Fe\) est plus réducteur que \({H_2}\). 0,25 pt
Dans le sécher B : il n'y a pas de réaction entre \(Ag\) Et \({H_3}{O^ + }\), donc \(Ag\) moins réducteur que \({H_2}\). 0,25 pt
le classement des métaux par pouvoir réducteur croissant \(Ag\), est moins réducteur que \(Fe\).
Exercice 3 : Utilisation des savoirs
Montage approprié au dosage : 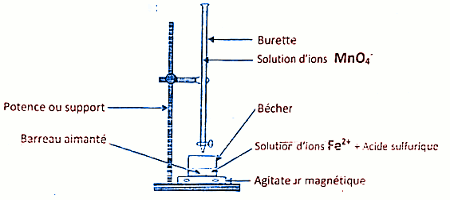 5.2.1 La fin du dosage est vérifiée par la persistance de la coloration violette dans le bécher 1 pt
5.2.1 La fin du dosage est vérifiée par la persistance de la coloration violette dans le bécher 1 pt
3.2.2 Équation - bilan du dosage:
Demi-équations :
\(F{e^{2 + }} \to \) \(F{e^{3 + }} + {e^ - }\)
\(MnO_4^ - + 8{H_3}{O^ + }\) \( + 5{e^ - } \to M{n^{2 + }}\) \( + 12{H_2}O\)
D'où l'équation-bilan :
\(MnO_4^ - + 8{H_3}{O^ + }\) \( + 5F{e^{2 + }} \to M{n^{2 + }}\) \( + 12{H_2}O + 5F{e^{3 + }}\)
3.2.3 Déduction de la relation qui permet de déterminer Cr la concentration en ions \(F{e^{2 + }}\)
D'après l'équation-bilan :
\(\frac{{{n_{F{e^{2 + }}}}}}{5} = {n_{MnO_4^ - }}\) \( \Rightarrow \frac{{CrVr}}{5} = \) \(CoVo\)
\(Cr = \frac{{5CoVo}}{{Vr}}\) \( = 0,87\) moL/L 0,5 X2 = 1 pt
Partie B : Évaluation des compétences
NB : Au-delà de la méthodologie appliquée ci-dessous pour le tellement des situations – problèmes
• Apprécier toute démarche allant dans le sens de la résolution des tâches:
• Apprécier les critères indépendamment les uns ces autres;
• Accorder la totalité des points alloués à une tâche aux candidats qui la résolvent avec succès sans dessous.
Situation - problème 1 :
Tâche
• Problème scientifique posé :
Il s'agit de vérifier la solubilité dans l'eau du contenu du flacon, tout en sachant que les alcanes ne sont pas solubles dans l'eau.
• Protocole de résolution :
Pour cela, nous allons:
♠ Prélever un échantillon du flacon et l'introduire dans une fiole contenant de l'eau ;
♠ Boucher la fiole et agiter le mélange (homogénéisation);
♠ Laisser reposer la fiole et observer.
• Conclusion :
♠Si formation de deux phases (les deux liquides ne se mélangent pas, présence de deux parties ou mélange hétérogène), alors ce liquide n'en pas soluble dans l'eau : il s'agit d'un alcane.
♠S'il y a dissolution (mélange homogène, une seule phase), on conclut qu'il ne s'agit pas d'un alcane.
Tâche 2 : Les points ont été reversés à la Tâche 1
• Problème posé :
Il s'agit de déposer du nickel sur une pièce métallique par électrolyse.
• Protocole de résolution :
Pour cela nous allons procéder à une électrolyse à anode soluble en nickel,
• Exécution du protocole :
♠ Constitution d'un circuit électrique constitué d'un électrolyseur alimenté par un générateur de courant continu
♠ Électrolyte : solution renfermant des ions nickel avec une anode en nickel et une cathode constituée de la pièce métallique.
♠ Au cours de l'électrolyse, les réactions suivantes se déroulent aux électrodes :
Cathode (-) : \(N{i^{2 + }} + 2{e^ - }\) \( \to Ni\)
Anode (+):\(Ni \to N{i^{2 + }}\) \( + 2{e^ - }\)
L’équation-bilan de l'électrolyse est : \(Ni(Anode) \to \) \(Ni(Cathode)\)


