Partie A : Évaluation des ressources ( 24 points)
Exercice 1: Vérification des savoirs / 8 points
1. Définir : molécule chirale, oxydation.
2. L’éphédrine est une amine de formule \({C_6}{H_5} - CHOH - \) \(CH(C{H_3}) - NH - C{H_3}\). Entourer la fonction amine de ce composé et préciser sa classe. 1 pr
3. L'acide propénoïque \(C{H_3} - C{H_2} - COOH\) est un acide faible.
Ecrire son équation de mise en solution dans l'eau. 1 pt
4. Qualifier de vraie ou fausse l'affirmation suivante :
Deux énantiomères ont certaines propriétés physiques et chimiques différentes.
5. Calculer la f.é.m. d'une pile réalisée avec les couples \(P{b^{2 + }}/Pb\) et \(A{l^{3 + }}/Al\).
On donne : E \({E^o}\left( {P{b^{2 + }}/Pb} \right)\) \( = - 0,13V\) et \({E^o}\left( {A{l^{3 + }}/Al} \right)\) \( = - 1,66V\)
6. Compléter la phrase suivante par la proposition qui convient entre (a), (b) ou (c):
« L'acide chlorhydrique attaque… »
(a) tous les métaux;
(b) certains métaux;
(c) aucun métal.
7. Énoncer deux conditions nécessaires pour une réaction de dosage.
Exercice 2 : Application des savoirs / 8 points
1. Donner les formules semi-développées des composés dont les noms suivent : 2 pts
(a) acide 2,3-diméthylbuthanoique ;
(b) N,N- éthyl- 3-méthylpentanamide.
2. Nommer le composé de formule semi-développée \(\begin{array}{*{20}{c}}{}&{{C_2}{H_5}}&{}\\{}&|&{}\\{C{H_3} - }&{CH}&{ - C{H_2} - N{H_2}}\end{array}\):
3. Calculer le pH d'une solution de monobase forte de concentration \({C_B} = 2 \times {10^{ - 2}}\) mol/L.
4. Trois tubes à essai numérotés I, II et III contiennent chacun un seul des trois alcools suivants : \(C{H_3} - C{H_2}\) \( - C{H_2} - OH\), \(\begin{array}{*{20}{c}}{}&{OH}&{}\\{}&|&{}\\{C{H_3} - }&{CH}&{ - C{H_3}}\end{array}\) et \(\begin{array}{*{20}{c}}{}&{CH3}&{}\\{}&|&{}\\{C{H_3} - }&{C(OH)}&{ - C{H_3}}\end{array}\) (l'ordre de numérotation des tubes ci-dessus ne correspond pas à l'ordre dans lequel les différents alcools sont donnés ici). L'alcool contenu dans le tube I réagit avec l'ion permanganate pour donner une cétone, celui contenu dans le tube Il ne réagit pas avec l'ion permanganate. Préciser l’alcool qui est contenu dans chaque tube.
5. Sachant que la glycine a pour formule \(\begin{array}{*{20}{c}}{}&{N{H_3}}&{}\\{}&|&{}\\{H - }&{CH}&{ - COOH}\end{array}\) et l’alanine \(\begin{array}{*{20}{c}}{}&{N{H_3}}&{}\\{}&|&{}\\{C{H_3} - }&{CH}&{ - COOH}\end{array}\), donner la formule semi-développée du dipeptide Ala-Gly. 1,5 pt
Exercice 3 : Utilisation des savoirs / 8 points
1. On réalise l'expérience suivante :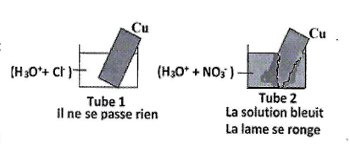 1.1- Opérer à un classement des couples : \(NO_3^ - /NO\) ; \(C{u^{2 + }}/Cu\) et \({H_3}{O^ + }/{H_2}\) mis en jeu. 1pt
1.1- Opérer à un classement des couples : \(NO_3^ - /NO\) ; \(C{u^{2 + }}/Cu\) et \({H_3}{O^ + }/{H_2}\) mis en jeu. 1pt
1.2 L'une des demi-équations de la réaction qui se produit dans le tube 2 est \(NO_3^ - + 4{H_3}{O^ + }\) \( + 3{e^ - } \to \) \(NO + 6{H_2}O\)
A partir des demi-équations, écrire l'équation-bilan de la réaction dans le tube 2. 1pt
2. On réalise une pile à l'aide des deux couples redox \(P{b^{2 + }}/Pb\) et \(A{l^{3 + }}/Al\).
2.1- Faire le schéma complet et annoté de cette pile. 2 pt
2.2 Écrire l'équation-bilan de la réaction lorsque la pile fonctionne. 1pt
On donne : \({E^o}\left( {P{b^{2 + }}/Pb} \right)\) \( = - 0,13V\)et \({E^o}\left( {A{l^{3+ }}/Al} \right)\) \( = - 1,66V\)
3. Soit la réaction chimique \(A + B \to \)\(C + {H_2}O\) où A est \(C{H_3} - C{H_2}\) \( - C{H_2} - OH\) et B est \(C{H_3} - COOH\).
3.1- En déduire la formule semi-développée de C. Quelles sont la fonction et le nom de C. 1pt
3.2- On obtient 7,7g de C à partir de 0,1 mole de A et 0.3 mole de B.
Calculer le pourcentage de C formé par rapport à ce que donnerait une réaction totale. 1 pt
33- indiquer le nom d'un produit D permettant d'obtenir C par une réaction totale sur A. 1pt
On donne en g/mol: C (12); H (1); O (16).
Partie B : Évaluation des compétences / 16points
Situation-problème : contrôle de qualité.
L'emballage d'un produit commercial porte l'indication « solution d'acide éthanoïque : 120 g/L ».
Lors d'une descente de la brigade de contrôle du ministère du commerce, ce produit est soupçonné d'être issu de la contrefaçon, sur la base de certains indices.
Une agence de contrôle de qualité est alors commise par les autorités compétentes pour vérifier les informations portées sur son emballage. Ces autorités leur assignant deux objectifs :
• Vérifier qu'il s'agit bien d'une solution d'acide éthanoïque
• Vérifier que sa concentration est celle indiquée sur l'étiquette.
Les qualiticiens de l'agence de contrôle procèdent alors au dosage pli-métrique de 20 ml, du produit à l'aide d'une solution d'hydroxyde de sodium de concentration CB= 0,1 mol/L. Les mesures ont permis d'obtenir la courbe suivante. 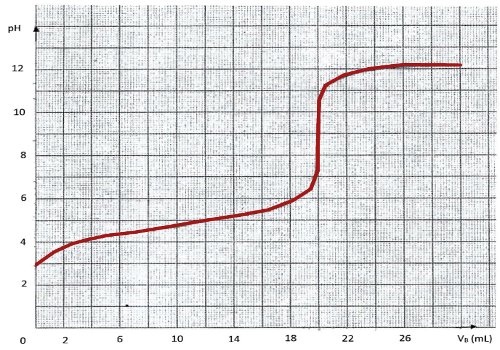 On sait en plus que : \(pKa\) \(\left( {C{H_3}COOH/CHCO{O^ - }} \right)\) = 4,75.
On sait en plus que : \(pKa\) \(\left( {C{H_3}COOH/CHCO{O^ - }} \right)\) = 4,75.
Suppose que tu sois en stage dans cette entreprise et qu'on te confie ce dossier.
1- En t’aidant des données et des informations à ta disposition, rédige le protocole permettant de réaliser ce dosage (du prélèvement du produit à l'obtention des mesures qui ont permis de tracer la courbe ci-dessus. 6pt
2- Exploite ces données et ces informations et prononce-toi sur les préoccupations portées dans le cahier de charge de l'agence de contrôle de qualité par les autorités. 10 pt
On donne en g/mol: C (12); H (1); 0 (16).
La qualité de la rédaction sera valorisée. La démarche adoptée pour accomplir chaque tâche devra s'accompagner, à chaque étape, quand cela est nécessaire, de la précision sur le matériel utilisé, et des marques justifiant l'exploitation du graphique (à remettre avec la copie) ci-haut


