Instruction
Choisir la bonne réponse.
51 Dans l’atome de cuivre \({}_{29}^{63}Cu\) il y a :
a. 27 neutrons, 36 protons, 31 électrons
b. 63 nucléons, 27 protons, 27 électrons
c. 27 neutrons, 63 nucléons, 27 protons
d. 27 neutrons 36 protons, 36 électrons
52 Les isotopes du carbone \({}^{12}C\) et \({}^{13}C\) ont :
a. La même masse moléculaire
b. Le même nombre de protons
c. Le même nombre d’électrons même nombre de neutrons
53 L’anion bromure \({}_{35}^{80}B{r^ - }\)
a. Possède 35 protons et 45 neutrons
b. A une masse moléculaire de 80 g/mol
c. Possède 81 nucléons et 36 électrons
d. Possède 36 électrons et 45 neutrons
54 Combien d’électrons possède le dernier atome de la deuxième période ?
a. 6
b. 10
c. 12
d. 18
e. 8
55 Dans quelle famille peut-on classer l’élément de numéro atomique Z=35 ?
a. Dans les métaux de transition
b. Dans les actinides
c. Dans les halogènes
d. Dans les alcalins
e. Dans les gaz rares
56 Dans la molécule de \(PC{l_5}\),
a. Le phosphore est entouré de 10 électrons
b. L’atome de chlore respecte la règle de l’octet
c. Le phosphore respecte la règle de l’octet
d. Au moins un des atomes de chlore ne respecte pas la règle de l’octet
57 Combien de liaisons peut-on au maximum former dans une molécule comportant 4 atomes de carbone et 10 atomes d’hydrogène
a. 4
b. 6
c. 9
d. 13
e. 15
58 Parmi les expressions suivantes, laquelle permet de déterminer le pH à l’équilibre d’une solution d’acide fort de concentration C.
a. \(pH = \frac{1}{2}(pKe + \) \(pKa + \log C)\)
b. \(pH = 14 + \log C\)
c. \(pH = - \log C\)
d. \(pH = pKa + \) \(\log \left( { - \frac{A}{{AH}}} \right)\)
e. \(pH = \frac{1}{2}(pKa\) \( - \log C)\)
59 Dans l’équilibre suivant, \(HCOOH + N{H_3}\) \( \to HCO{O^ - } + \) \(NH_4^ + \) , il y’a deux acides et deux bases conjugués. Les deux acides et les deux bases sont :
a. \(HCOOH\), \(N{H_3}\) et \(HCO{O^ - }\), \(NH_4^ + \)+
b. \(HCOOH\), \(NH_4^ + \) et \(HCO{O^ - }\), \(N{H_3}\)
c. \(HCO{O^ - }\), \(N{H_3}\) et \(HCOOH\), \(NH_4^ + \)
d. \(HCOOH\), \(HCO{O^ - }\) et \(N{H_3}\), \(NH_4^ + \)
60 Parmi les couples acides bases proposes quel est celui qui convient le mieux à la préparation d’une solution tampon à \(pH = 5\)
a. \(NH_3^ + /N{H_3}\), \(pKa = 9,25\)
b. \(HCO_3^ - /CO_3^2\), \(pKa = 10,30\)
c. \({H_2}PO_4^ - /HPO_4^2\), \(pKa = 4,3\)
d. \({H_2}C{O_3}/HC{O_3}\), \(pKa = 6,35\)
e. \(HCN/C{N^ - }\), \(pKa = 9,2\)
61 La valine est un des 20 acides aminés naturels et possède une fonction acide \( - COOH\) (\(pK{a_1} = 2,6\)) et une fonction amine \( - N{H_2}\) (\(pK{a_2} = 9,6\)).si on considère une solution de valine de pH = 10, 6, quelle proportion (%) de forme zwitterionique de la solution.
a. 2, 4
b. 3, 6
c. 5, 7
d. 9, 1
e. 10, 2
62 Quelle(s) est (sont) la (les) proposition(s) exacte parmi les suivantes ?
a. \(Ka\) et \(Kb\) sont deux grandeurs indépendantes
b. \(pKa + \) \(pKb = 0\)
c. \(pKa + \) \(pKb = 14\)
d. On peut caractériser un couple acide/base indifféremment par le \(Ka\) de sa base ou le \(Kb\) de son acide.
e. Les valeurs de \(Ka\) et \(Kb\) étant en général très grandes, on passe à une échelle logarithmique pour les utiliser.
63 Quelle(s) est (sont) la (les) proposition(s) exacte parmi les suivantes ?
a. Le quotient d’autoprotolyse de l’eau est noté \(Ke\) et appelé produit ionique de l’eau.
b. A 25 \({}^0C\), \(Ke = {10^{ - 14}}\)
c. \(pH = pKe\) \( - pKb\).
d. Dans une solution neutre, \({H_3}{O^ + }\) et \(O{H^ - }\) sont équimolaire à \({10^{ - 7}}\) mol/l.
64 Le phénol (\({C_6}{H_5}OH\)) et l’acide hexanoique (\({C_6}{H_5}COOH\)) ont des \(Ka\) respectifs égaux à \(1,3 \times {10^{ - 10}}\) et \(1,26 \times {10^{ - 5}}\).
On peut donc dire que :
a. La dissociation du phénol est moins importante que celle de l’acide hexanoique
b. Le phénol est un acide plus fort que l’acide hexanoique
c. La dissociation du phénol est plus importante que celle de l’acide hexanoique
d. L’acide hexanoique est un acide plus fort que phénol.
e. On ne peut pas comparer ces acides sans calculer leur pka.
65 Parmi les solutions aqueuses suivantes dont le contenu est décrit, la(les) quelle(s) possède(nt) un pouvoir tampon ?
a. HCOON et \(HCOON{H_4}\)
b. HCl et NaOH
c. \({H_2}S{O_4}\) et \({H_2}S{O_3}\)
d. \(KB{\left( {OH} \right)_4}\) et \(KB{\left( {OH} \right)_3}\)
e. HCN et \(CaC{N_2}\)
66 La mesure du pH d’un patient montre qu’avant le traitement médicamenteux, il est de 6,7, et qu’après il est de 7,3.
La concentration en \({H_3}{O^ + }\) dans le sang du fait du traitement a donc été : (données : \(\log 2 = 0,3\), \(\log 5 = 0,7\))
a. Divisée par 2
b. Multipliée par 4
c. Divisée par 4
d. Multipliée par 2
e. Divisée par 3
67 On dose \({V_1} = \) = 100mL d’un monoacide faible (\(pKa = 5\)) de concentration \({C_1} = 4 \times {10^3}\) m par une monobase forte (\(pKb = 8\)) de concentration \({C_2} = 4 \times {10^{ - 2}}\) mol/L
a. A la demi-équivalence, \(pH = pKb\)
b. A l’équivalence, \(pH = 7 + \) \(\frac{1}{2}pKa + \) \(\frac{1}{2}\log {C_2}\)
c. La base est majoritaire donc \(pH = pKa + \) \(og\frac{{\left[ {acide} \right] - \left[ {base} \right]}}{{base}}\)
d. A la demi-équivalence, pH = 8
e. Juste après l’équivalence, le pH est encore légèrement acide.
68 Quel est le nombre d’oxydation du soufre dans le composé \({S_2}O_3^{2 - }\) ?
a. 6
b. 4
c. 2
d. 0
e. -2
69 Le brome de \(BrO_3^ - \) est réduit en \(B{r_2}\) avec un échange de :
a. 2 électrons et 1 proton
b. 5 électrons et 6 protons
c. 10 électrons et 12 protons
d. 15 électrons
70 Voici le diagramme simplifié d’énergie du mercure (sans souci d’échelle) : Données : Constante de Planck h = 6, 62 × \({10^{ 34}}\) J.s. Célérité de la lumière dans le vide c = 3 \({10^{ 8}}\)m = s, 1eV = 1, 6 × \({10^{ - 19}}\)J. Cocher la ou les bonnes réponses
a. Les transitions indiquées correspondent à des radiations absorbées
b. Les fréquences des trois radiations indiquées sont : 8 × \({10^{ 4}}\) Hz ; 1, 2 × \({10^{ 15}}\) Hz ; 6 × \({10^{ 15}}\) Hz ;
c. Les longueurs d’ondes des transitions sont : 405nm ; 410nm ; 434nm.
d. La plus petite longueur d’onde vaut 390nm
71 La réaction \(C{H_3} - C{H_2} - \) \(OH \to C{H_2}\) \( = C{H_2} + {H_2}O\) en présence de \(A{l_2}{O_3}\) à 400 \(^oC\) est une :
a. Réaction de substitution
b. Réaction d’addition
c. Réaction de polymérisation
d. Réaction de combustion d’élimination
72 On considère les représentations ci-dessous : Soient les affirmations suivantes :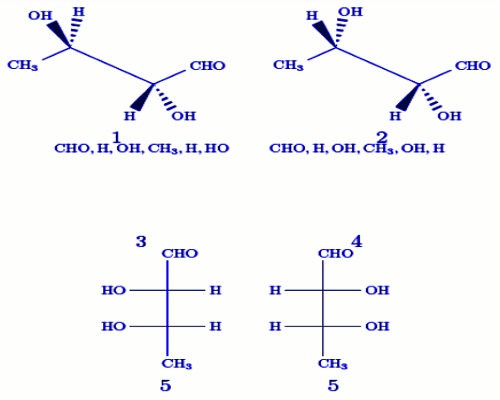 a. 1 et 2 sont stéréo-isomères.
a. 1 et 2 sont stéréo-isomères.
b. 5 et 6 sont identiques
c. 3 est la représentation exacte de 1 en projection de Newman
d. 4 est la représentation exacte de 2 en projection de Newman
e. 5 est la représentation exacte de 2 en projection de Fischer
f. 6 est la représentation exacte de 1 en projection de Fischer
g. 6 appartient à la série L
Choisissez parmi les combinaisons suivantes celle regroupant toute les affirmations exactes.
a. a + d + f + g
b. c + d + e + f
c. a + c + d + f
d. a + b + c + e
73 Quel volume de 10mol/L d’\({H_2}S{O_4}\) est nécessaire pour préparer 600ml de 0, 5M \({H_2}S{O_4}\) ?
a. 3mL
b. 30mL
c. 6mL
d. 600mL
74 Si le \(Ka\) de AgCl est A et la concentration de \(C{l^ - }\) dans le récipient est B molaire, quelle est la concentration de \(A{g^ + }\) en mole par litre ?
a. A mol/L
b. B mol/L
c. 6A/B mol/L
d. B ou C
75 Si 8A passent pendant 2min a la cathode (ou la réaction suivante a lieu \(A{g^ + } + e\) \( \to Ag(S)\) combien de gramme d’Ag(s) se plaquent sur la cathode? (Ag=108g/mol)
a. 0, 96g
b. 1, 02g
c. 1, 07g
d. 1, 12g

