Partie A : Évaluation des ressources : 24 points
Exercice 1 : Vérification des savoirs : 8 points
1-Définir : facteur cinétique ; réaction rapide. 3pts
2- Choisir la réponse juste parmi celles proposées ci-dessous : 1 pt
2-1-Une solution dont le pH est voisin ou égal au \(pKa\) du couple acide-base correspondant est appelée:
i) solution amphotère;
ii) solution tampon ;
iii) solution racémique.
2-2- Pour le couple \(C{H_3}NH_3^ + /C{H_3}N{H_2}\), la base est :
i) \(C{H_3}N{H_2}\);
ii) \(C{H_3}NH_3^ + \);
iii) \(N{H_3}\)
3- Nommer la famille des réactions qui permettent de passer d’une amine à une amine de classe supérieure. 1 pt
4- Donner la différence entre l°isomérie de constitution et la stéréo-isomérie. 1 pt
5- Écrire en fonction de \(n\), entier naturel non nul, la formule générale d’un ester à chaine carbonée saturée. 1 pt
6- Nommer la liaison qui résulte de la réaction de condensation de deux acides alpha -aminés. 1 pt
Exercice 2 : Application des savoirs : 8 points
1- Écrire les formules semi-développées des composés suivants : 2pts
i) N-méthylpropanamide;
ii) 2-méthylbutanoate de l-méthylpropyle.
2- Nommer le composé ci- dessous en utilisant la nomenclature officielle.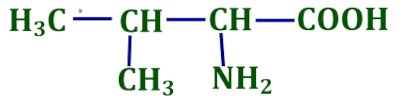 3- On synthétise un ester par action de l’éthanol sur l’acide éthanoïque.
3- On synthétise un ester par action de l’éthanol sur l’acide éthanoïque.
3-1- Écrire l’équation-bilan de la réaction qui se produit. 1 pt
3-2- A \( t = 0\), on mélange 0,6 mol d’acide éthanoïque et 0,6 mol d’éthanol.
Déterminer le nombre de mole d’ester obtenu pour un rendement de 67%.1 pt
3-3- Déterminer la vitesse de formation de l’ester obtenu à une date \({t_1}\) sachant que celle de disparition de l’acide éthanoïque à la même date est \(8 \times {10^{ - 3}}\) mol.min-1. 1 pt
3-4- Représenter l’allure (sans souci d’échelle) de la courbe de formation de la quantité de matière d ester en fonction du temps. 1 pt
Exercice 3 : Utilisation des savoirs : 8 points
On effectue le dosage d’un volume \({V_A} = 20\) mL d’une solution d’acide lactique de formule \(C{H_3} - CH(OH) - COOH\) ( que l’on pourra noter AH) par une solution aqueuse d’hydroxyde de sodium (\(N{a^ + } + H{O^ - }\)) de concentration \({C_B} = 0,5\) mol/L. Les mesures du pH du mélange en fonction du volume de base versée sont données dans le tableau suivant : 1-Tracer sur papier le millimétré la courbe donnant les variations du pH en fonction du volume de la base versée \(pH = f\left( {{V_B}} \right)\). 2 pts
1-Tracer sur papier le millimétré la courbe donnant les variations du pH en fonction du volume de la base versée \(pH = f\left( {{V_B}} \right)\). 2 pts
Échelle : l cm pour 1 mL et l cm pour une unité de pH.
2- Déterminer à partir de la courbe, le volume de base versée \({{V_{BE}}}\) à l’équivalence. 2pts
3- Déduire la concentration molaire \(C_A\) de la solution d’acide lactique.1 pt
4- Lorsqu’on a versé un volume \(V_B\) = 4 mL de solution d’hydroxyde de sodium, lire le pH correspondant puis déterminer les concentrations des ions hydroxyde, hydronium et lactate \(C{H_3} - CH(OH) - COOH\) ou \({A^ - }\) présents dans le mélange. 3pts
Partie B: Évaluation des compétences : 16 points.
Des sachets d'aspirine en poudre portant tous l'étiquette « aspirine 100 mg » ont été livrés à un établissement scolaire. Malheureusement le nombre reçu est en deçà de celui attendu.
Soucieux et enthousiastes, deux élèves Eric et Viviane de cet établissement se proposent des défis suivants :
Défi de Eric : synthétiser 100 g d’aspirine.
Défi de Viviane : vérifier la masse effective d’aspirine dans un sachet de la livraison.
Opérations effectuées par Eric :
Dans un erlenmeyer, bien sec, sous hotte, il introduit :
• \(m_1\) = 80 g d’a¢ide sa1i¢y1ique;
• \(V_2\) = 100 mL d’anhydride éthanoïque ;
• Quelques grains de pierre ponce.
Il adapte un réfrigérant à air sur l’erlenmeyer ;
Il se produit une réaction chimique aboutissant à l aspirine avec un rendement évalué à 85 %.
Opérations effectuées par Viviane :
Elle prépare une solution S en introduisant tout le contenu d’aspirine d’un sachet (100 mg) dans une fiole jaugée, puis y ajoute de l’eau distillée pour obtenir une solution de volume 500 mL.
Elle dose un volume \(V_A\) = 100 mL de cette solution S par une solution aqueuse solution S par une solution aqueuse d’hydroxyde de sodium (\(N{a^ + } + H{O^ - }\)) concentration molaire \({C_B} = {10^{ - 2}}\) moL/L en présence d’un indicateur coloré approprié.
Le volume de base obtenu à l’équivalence est \({V_{BE}} = 11,1\) mL.
Equation-bilan de synthèse de l’aspirine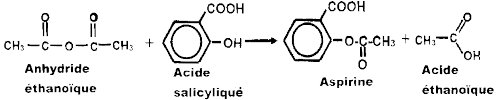 En utilisant les informations ci-dessus et en effectuant obligatoirement des calculs,
En utilisant les informations ci-dessus et en effectuant obligatoirement des calculs,
1- Examine si Eric a relevé son défi ou non. 8pts
2- Exploite les résultats des travaux de Viviane et prononce-toi sur la masse d’aspirine (100 mg) inscrite sur l’étiquette d’un sachet. 8pts
On donne : Masse volumique de l'anhydride éthanoïque. \(\rho = 1080g.{L^{ - 1}}\)
Masses molaires en g/mol: aspirine :180 ; acide salicylique : 138 ; anhydride éthanoïque : 102

