PARTIE A : Évaluation des Ressources /24 points
Exercice 1 : Vérification des savoirs / 8 points
1-Définir
Facteur cinétique : Paramètre qui influence la vitesse d'une réaction chimique. 1 pt
Réaction rapide : Réaction qui se produit instantanément après contact des réactifs. 1 pt
2. Choix de la bonne réponse :
2.1 ii) solution tampon : 0,5pt
2.2 i) \(C{H_3}N{H_2}\) 0,85 pt
3. Réaction d’ Hofmann 1 pt
4. Dans l’isomérie de constitution, les isomères diffèrent par leurs formules semi-développées planes tandis qu'en stéréo-isomérie ils différent par la disposition spatiale des atomes.
Accepter aussi : Dans l’ isomérie de constitution on rencontre l’isomérie de chaîne , de position ct de fonction tandis que dans la stéréo-isomérie on rencontre l’isomérie de configuration (Z/ E , énantiomère conformation ).
5. Formule générale des esters : \({C_n}{H_{2n}}{O_2}\) avec \(n \ge 2\) 1 pt
6. Liaison peptidique 1 pt
Exercice 2 : Application des savoirs / 8 points
1. Formule semi-développées des composés
i) N-méthylpropanamide 1 pt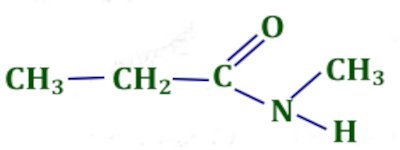 ii) 2-méthylbutanoate de l-méthylpropyle. 1 pt
ii) 2-méthylbutanoate de l-méthylpropyle. 1 pt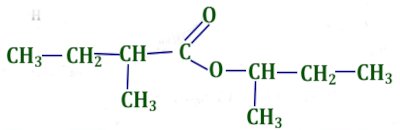 2. Acide 2-amino-3-méthylbutanoique
2. Acide 2-amino-3-méthylbutanoique
3.
3. L’équation bilan de la réaction 1 pt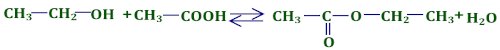 3.2. Déterminons le nombre de mole d'ester
3.2. Déterminons le nombre de mole d'ester
• Rd = nombre de mole d’ester obtenue \(\left( {{n_{ob}}} \right)\) sur nombre de mole d’ester attendue \(\left( {{n_{at}}} \right)\) si la réaction est total le tout multiplié par 100
• Nombre de mole d’ester obtenue (n = mole d’ester attendue si la réaction est total divisé par 100 le tout multiplié par le rendement.
Soit \({n_{ob}} = \frac{{{n_{at}} \times Rd}}{{100}}\)
\({n_{ob}} = \frac{{0,6 \times 67}}{{100}}\) \( = 0,402\) mol 1 pt
33. les coefficients stœchiométriques étant les mêmes dans l’equation-bilan .
La vitesse de formation \({V_f}\) de l’ester égale a la vitesse de disparition \({V_d}\) de l’acide éthanoïque.
\({V_f} = {V_d} = 8 \times {10^{ - 3}}\) mol/min 1 pt
3.4. Allure de la courbe de formation de l’ester :
Exercice 3 : Utilisation des savait: / 8 points
1. Courbe donnant \( pH = f(V_b)\) 2 pts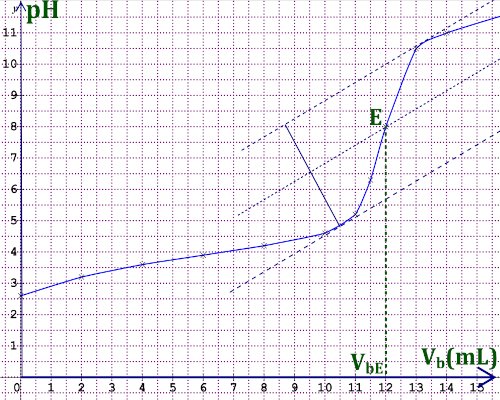 2. A partir la méthode des tangentes on trouve \({V_{bE}} = 12\) mL 2 pts
2. A partir la méthode des tangentes on trouve \({V_{bE}} = 12\) mL 2 pts
3. Déduisions la concentration \({C_A}\) d’acide lactique. 1 pt
A l'équivalence on a :
\({C_A}{V_A} = {C_B}{V_{BE}}\) \( \Rightarrow {C_A} = \frac{{{C_B}{V_{BE}}}}{{{V_A}}}\)
\({C_A} = 0,3\) mol/L
4. déterminons les concentrations des ions hydroxyde,
\({V_A} = 4\) ml et \(pH = 3,6\)
• Détermination des concentrations :
\(\left[ {{H_3}{O^ + }} \right] = {10^{ - pH}}\) soit \(\left[ {{H_3}{O^ + }} \right] = 2,51 \times {10^{ - 4}}\)
\(Ke = \left[ {{H_3}{O^ + }} \right]\left[ {H{O^ - }} \right]\) \( \Rightarrow \left[ {H{O^ - }} \right] = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 3,6}}}}\) \( = 3,98 \times {10^{ - 11}}\) mol
On Remarque que \(\left[ {H{O^ - }} \right] \ll \left[ {{H_3}{O^ + }} \right]\)
Electroneutralité
\(\left[ {H{O^ - }} \right] + \left[ {{A^ - }} \right]\) \( = \left[ {{H_3}{O^ + }} \right] + \left[ {N{a^ + }} \right]\) 0,5pt
Avec \(\left[ {N{a^ + }} \right] = \frac{{{C_B} \times {V_B}}}{{Vr}}\)
\(\left[ {{A^ - }} \right] = {10^{ - pH}} + \frac{{{C_B} \times {V_B}}}{{Vr}}\)
\(\left[ {{A^ - }} \right] = 8,33 \times {10^{ - 2}}\) mol/L 0,5 pt
PARTIE B : Évaluation des Compétences / 16 points
Examinons si Eric a relevé son défi. Pour cela on va : 1 pt
• Déterminer le réactif limitant
• Exploiter l'équation bilan de la réaction ;
• Déterminer la masse d'aspirine synthétisé ;
• Comparer à la masse escomptée
• Conclure
1) Détermination du réactif limitant 1 pt
Soit \({n_{as}}\) la quantité de matière d'aspirine et \({n_{ac}}\), celle de l'anhydride éthanoique.
\({n_{as}} = \frac{{{m_{as}}}}{{{M_{as}}}} = \) \(\frac{{80}}{{138}} = 0,58\)
\({n_{ac}} = \frac{{{m_{ac}}}}{{{M_{ac}}}} = \) \(\frac{{\rho .V}}{{{M_{ac}}}} = 1,05\)mol 1 pt
\({n_{as}} \prec {n_{ac}}\) donc l'acide salicylique est le réactif limitant.
• Détermination de la masse d'aspirine synthétisée. 4 pts
Soit: \({m_3}(obt)\) la masse d'aspirine obtenue et \({m_3}(att)\) celle d'aspirine attendue théoriquement
\({m_1}\) la masse d'acide salicylique et \({M_1}\) la masse molaire d'acide salicylique
\(Rd = \frac{{{m_3}(obt)}}{{{m_3}(att)}} \times 100\) d’après l’équation-bilan \(\frac{{{m_1}}}{{{M_1}}} = \frac{{{m_3}(att)}}{{{M_3}}}\)
d'où \({m_3}(att) = \frac{{{m_1}}}{{{M_1}}}{M_3}\)
\(Rd = \frac{{{m_3}(obt)}}{{\frac{{{m_1}}}{{{M_1}}}{M_3}}} \times 100\) \( \Rightarrow {m_3}(obt) = \frac{{{m_1}}}{{{M_1}}}\) \({M_3}.\frac{{Rd}}{{100}}\)
AN : \({m_3}(obt) = 88,7\)
Conclusion : \(88,7g \prec 100g\) donc Erie n'a pas relevé son défi. 1 pt
2 : Vérification de la masse d'aspirine sur l'étiquette.
Démarche : 1 pt
• Écrire la relation à l'équivalence
• Déterminer ln concentration \(Ca\) de la solution d’aspirine ;
• Déterminer la masse d'aspirine contenu dans la solution préparée ;
• Comparer à la masse de l'étiquette puis conclure.
Relation à l'équivalence
Il s'agit du dosage de l'aspirine contenant une fonction acide carboxylique par une monobase forte (hydroxyde de sodium)
Équation bilan de la réaction du dosage : 2 pts
I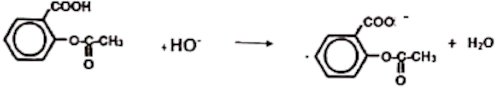 Détermination la concentration \(Ca\) de la solution d’aspirine : 1,5 pt
Détermination la concentration \(Ca\) de la solution d’aspirine : 1,5 pt
A l'équivalence, on a : \({n_{H{O^ - }}} = {n_{aspirine}}\) soit \({C_A} = \frac{{{C_B}{V_{BE}}}}{{{V_A}}}\)
\({C_A} = 1,11 \times {10^{ - 3}}\) mol/L
Détermination la masse d'aspirine contenue dans la solution préparée (V = 500 mL) 1,5pt
\({n_{asp}} = \frac{{{m_{asp}}}}{{{M_{asp}}}} = {C_A}V\) \( \Rightarrow {m_{asp}} = {C_A}V \times {M_{asp}}\) \( = 0,0999g\) soit 100g
Conclusion : La masse sur le sachet d’aspirine est conforme.

