Évaluations des savoir-faire et des compétences pratiques
1- Identification de la verrerie : 5pts
1.1. Nommer les verreries suivantes :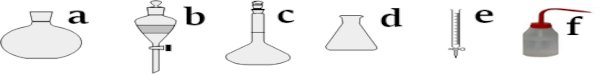 1.2. Quelle est la différence entre la pipette graduée et la pipette jaugée et laquelle est la plus précise ?
1.2. Quelle est la différence entre la pipette graduée et la pipette jaugée et laquelle est la plus précise ?
1.3. Quel est le rôle des éléments de verrerie suivants :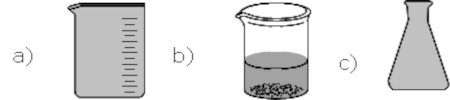
2-Sécurité au laboratoire/ 5pts
2.1. Pourquoi doit-on mettre une blouse dans un laboratoire de chimie ?
2.2. Quelles sont les différentes informations que l'on peut lire sur l'étiquette d'un produit chimique ?
2.3. Donner la signification des pictogrammes suivants ? 2.4. Que devez-vous faire dans les circonstances suivantes ?
2.4. Que devez-vous faire dans les circonstances suivantes ?
a- Des produits chimiques sont projetés dans vos yeux
b- Les vêtements d’un apprenant prennent feu.
3- :Partie Expérimentale
3.1- dans un laboratoire de chimie du Lycée, on rencontre une bouteille portant pour seules indication:« Solution d'acide sulfurique; 900 ml; pourcentage massique en acide: 96 % ; d=1,83; M=98,08. »
3.1.1- Quelle est la masse d'acide sulfurique pur contenu dans la bouteille ?
3.1.2-Quelle est sa concentration massique ? Quelle est sa concentration molaire ?
3.1.3- Pour préparer 1L de solution diluée, on utilise un volume V=20 ml de l'acide concentré contenu dans cette bouteille.
- Quelle est la concentration molaire de la solution diluée d'acide sulfurique?
-Décrire, en quelques lignes, le protocole de préparation de l'acide dilué, en précisant la verrerie utilisée.
3-2-Dosage d'une solution aqueuse d'acide acétylsalicylique
3.2.1- Produits chimiques et Matériels Par poste de travail :
-1 support -1 bécher de 50 ml – une solution de NaOH - 2 pipettes de 10ml-3 erlenmeyers de 50ml - Solution acide à titrer -1 Éprouvette graduée de 10 ml -1 agitateur phénolphtaléine
3-2-2-Mode opératoire
Pipeter 10 ml de solution de NaOH (C1=10-2 mol/L ou C2=1,5 mol/L) et l’introduire dans un erlenmeyer. Ajouter 2 ou 3 gouttes de phénolphtaléine. Remplir la burelle avec la solution d'acide acétylsalicylique (aspirine 500), puis ajuster correctement le zéro.
Faire couler progressivement la solution acide dans l'erlenmeyer, tout en agitant le mélange jusqu'au virage de l'indicateur coloré.
Noter le volume de la solution acide versé à l'équivalence. Faire un autre essai.
3-2-2-1-Réalisation du montage expérimental.
-Utilisation du matériel
-Respect des consignes de sécurité au laboratoire et de propreté dans la manipulation.
3-2-2-2- Déterminer le volume moyen \({V_A}\) d'acide obtenu.
3-2-2-3- Écrire l'équation-bilan de la réaction, si la formule de l'acide acétylsalicylique est: \(C{H_3}COO - {C_6}{H_4}\) \( - COOH\)
3-2-2-4- Que signifie l'expression « aspirine 500 ) inscrite sur l'étiquette de ces comprimés.
3-2-2-5- Déterminer la concentration \({C_A}\) de la solution acide.
3-2-2-6- Calculer la masse d'acide acétylsalicylique contenue dans un comprimé d'aspirine.
-Y a-t-il accord avec l'expression « aspirine 500 »?
Données : Masse molaire de l'acide acétylsalicylique; M=180glmol ; H=1 ; O=16

