PARTIE 1 : ÉVALUATION DES RESSOURCES 24 POINTS
EXERCICE 1 : VÉRIFICATION DES SAVOIRS 8Pt
1. Définir : 2pt
Catalyse homogène : catalyse au cours de laquelle le catalyseur et le réactif sont dans le même état physique.
Monobase forte : composé qui réagit totalement avec l’eau en fixant un proton.
2 b) Une solution tampon 1 pt
3 b) D’un sel d’ammonium quaternaire 1 pt
4 vrai 1pt
5 faux 1pt
6 b) la trempe de prise d’essai 1pt
7 a) Nucléophile 1pt
EXERCICE 2 : APPLICATION DES SAVOIRS 8pt
PARTIE A : / ÉNERGIE MÉCANIQUE / 4 Pt
1.1 Écrivons l’équation-bilan de cette réaction. 1pt
\({({C_2}{H_5})_3}N + C{H_3}\) \( - Cl \to {({C_2}{H_5})_3}{N^ + }C{H_3}\) \( + C{l^ - }\)
2.1 Calculons les quantités de matière en ion oxonium n(H3O+)1 et n(H3O+)2 dans chaque solution.0,5 x 2 = 1 pt
\(n{({H_3}{O^ + })_1} = \left[ {{H_3}{O^ + }} \right]\) \( \times V = 2,6 \times {10^{ - 4}}\) mol
\(n{({H_3}{O^ + })_2} = {\left[ {{H_3}{O^ + }} \right]_2}\) \( \times V = 2,0 \times {10^{ - 3}}\) mol
2.2 Calculons la quantité de matière d’acide \(H{A_1}\) et \(H{A_2}\), initialement présente dans les 200 mL de chaque solution avant toute réaction avec l’eau. 1 pt
\({n_{{A_1}}} = {n_{{A_2}}} = \) \({C_0} \times V = 2,0 \times {10^{ - 3}}\) mol
2.3 Des deux acides \(H{A_1}\) et \(H{A_2}\), l’acide fort est \(H{A_1}\) car \(n({H_3}{O^ + }) = {n_{{A_2}}}\) 1pt
3.1 Ce type de solution est appelle solution tampon 1pt
3.2 Importance de cette solution : Son pH varie peu par dilution modérée. 0,5pt
3.3 Déterminons les volumes \(Vb\) et \(Va\) nécessaires à la préparation de cette solution.
\(\left\{ \begin{array}{l} {C_B}{V_B} = \frac{1}{2}{C_A}{V_A}\\ {V_A} + {V_B} = 0,15 \end{array} \right.\) \( \Rightarrow {V_A} = 100\) mL et \({V_B} = 50\) mL
4. La molécule suivant 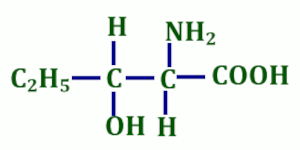 possède 4 énantiomères car elle renferme 2 carbones asymétriques.
possède 4 énantiomères car elle renferme 2 carbones asymétriques.
EXERCICE 3 : UTILISATION DES SAVOIRS : 8 pt
1 Le chauffage à reflux permet d’éviter les pertes de réactifs 1pt
2. Pour chacune des expériences ci-dessus décrite, déterminons le temps de demi-réaction \(r_1\) et \(r_2\) En déduire la réaction la plus rapide. 3pt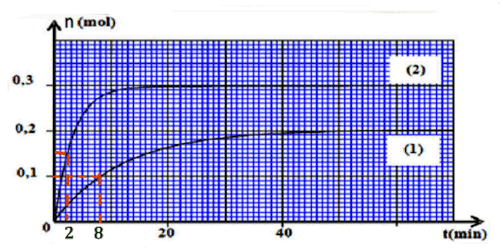 On note que \({r_1} = 8\) min \({r_2} = 2\) min. 0,5 pt x 2
On note que \({r_1} = 8\) min \({r_2} = 2\) min. 0,5 pt x 2
La réaction la plus rapide est la deuxième car \({r_2} \prec {r_1}\) 0,5 pt x 2
3. Pour chaque expérience ci-dessus décrite, déterminer le rendement de la réaction \(Rd_1\) et \(Rd_2\) .
\(R{d_1} \times {n_{a{l_1}}} = {n_{e{s_1}}} \Rightarrow \) \(R{d_1} = \frac{{{n_{e{s_1}}}}}{{{n_{a{l_1}}}}} = \frac{{0,2}}{{0,3}}\) \( = 0,67\) 1pt
\(R{d_2} \times {n_{a{l_2}}} = {n_{e{s_2}}} \Rightarrow \) \(R{d_2} = \frac{{{n_{e{s_2}}}}}{{{n_{a{l_2}}}}} = \frac{{0,3}}{{0,3}} = 1\) 1 pt
La réaction totale est la réaction 2 car\(R{d_2} = 100\% \) 1 pt
4. Écrivons l’équation-bilan de la réaction qui se produit lors de la deuxième expérience.
\(C{H_3}C{H_2}C{H_2}COO\) \(CC{H_2}C{H_2}C{H_3} + \) \(C{H_3}C{H_2}OH \Rightarrow C{H_3}C{H_2}\) \(C{H_2}COOC{H_2}C{H_3} + \) \(C{H_3}C{H_2}C{H_2}COOH\) 1 pt
PARTIE 2 : ÉVALUATION DES COMPÉTENCES 16 Pt
1. Problème scientifique : donner le protocole du dosage pH-métrique 2 pt
• Démarche à suivre:
• Faire le schema du dispositif expérimental.
• Donner le mode opératoire.
• Résolution
• Dispositif expérimental 2 pt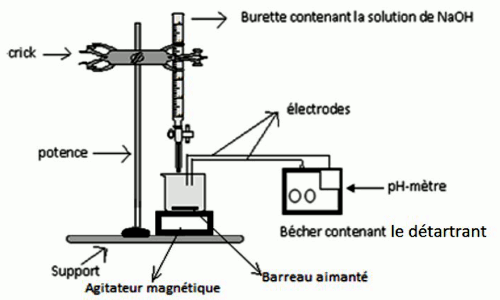 • Mode opératoire.
• Mode opératoire.
Prélever 0,26 g de détartrant l’introduire dans le bécher et la dissoudre totalement avec de l’eau distillée.
Introduire les électrodes du pH-mètre dans le bécher.
Remplir la burette avec la solution d’hydroxyde de sodium
Verser de petites quantités de base dans le bécher et noter à chaque fois la valeur du pH de la solution, et compiler tous les résultats obtenus dans un tableau.
2 : Dire si l’information marquée sur le sachet de détartrant est fiable.
Problème scientifique : Déterminer le pourcentage d’acide sulfonique contenu dans le détartrant.
Démarche à suivre:
Écrire l’équation bilan de la réaction ayant lieu.
Exploiter la courbe à fin de déterminer les coordonnées du point d’équivalence. 1 pt
Calculer la masse d’acide contenu dans l’échantillon dosé et en déduire son pourcentage.
Comparer.
Résolution:
Équation bilan de la réaction ayant lieu : 1pt
\(AH + H{O^ - } \to \) \({A^ - } + {H_2}O\)
Déterminer les coordonnées du point d’équivalence. 1 PT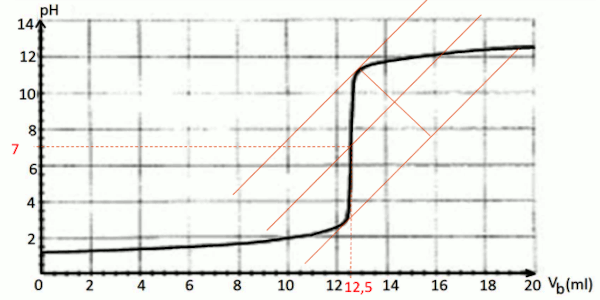 E (12,5ml ; 7) 0,5 pt
E (12,5ml ; 7) 0,5 pt
Calculons la masse d’acide contenu dans l’échantillon dosé. 1 pt
\({n_a} = {n_b} \Leftrightarrow {m_a}\) \( = {C_b}{V_{bE}}{M_a}\)
\({m_a} = 0,2425\)g
Déduire son pourcentage
\(\% AH = \frac{{{m_a}}}{m} = 0,93\)
Comparer. \(93\% \succ 80\% \) 05 pt
Conclusion : l’information marquée sur la boite n’est pas fiable. 1pt

