PARTIE A : ÉVALUATION DES RESSOURCES / 24pts
Exercice 1 : Vérification des savoirs / 8pts
1.1. Définition : 2pts
1.1.1. Dismutation : c’est une réaction au cours de laquelle le même élément s’oxyde et se réduit.1pt
1.1.2. Alkylation : c’est la réaction d’un chlorure d’alkyle \(R - Cl\) sur le benzène. 1pt
1.2. Composition du mélange sulfonitrique et rôle de chaque élément de ce mélange :
Le mélange sulfonitrique est un mélange de deux acides à savoir : l’acide sulfurique \({H_2}S{O_4}\) et l’acide nitrique HNO3 . 0,5ptx2
\({H_2}S{O_4} + HN{O_3} \to \) \(NO_2^ + + HSO_4^ - + {H_2}O\)
Chaque élément de ce mélange joue le rôle de réactif. 0,5pt
1.3. Trois applications de d’oxydoréduction par voie sèche : 0,5ptx3
On utilise l’oxydoréduction par voie sèche en sidérurgie, en aluminothermie, pour la préparation de l’acide nitrique et pour la préparation de l’acide sulfurique.
1.4. Répondre par vrai ou faux : 0,5ptx3
1.4.1. L’acide nitrique concentré attaque l’argent : VRAI
1.4.2. L’action du dichlore sur le benzène en présence de la lumière constitue une réaction de substitution : FAUX. (Réaction de substitution)
1.4.3. Les réactions d’électrolyse sont des réactions d’oxydoréduction naturelles : FAUX (car elle nécessite de l’énergie)
1.5. Formule développée du benzène ainsi que la mesure de ses angles valenciels : 1pt+0,5pt
Exercice 2 : APPLICATION DES SAVOIRS / 8pts
2.1 Nomenclauture 0,5x2 =1 pt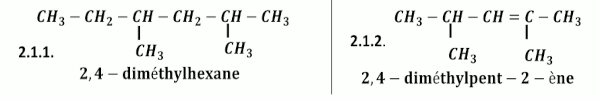 2.2. Formules semi-développées des composés :
2.2. Formules semi-développées des composés :  2.3. On réalise une pile à l’aide des couples rédox \(P{b^{2 + }}/Pb\) et \(A{l^{3 + }}/Al\).
2.3. On réalise une pile à l’aide des couples rédox \(P{b^{2 + }}/Pb\) et \(A{l^{3 + }}/Al\).
\({E^o}\left( {P{b^{2 + }}/Pb} \right) = 0,13V\) ; \({E^o}\left( {A{l^{3 + }}/Al} \right) = - 1,66V\)
2.3.1. Schéma annoté de la pile en indiquant sa polarité : 2pt 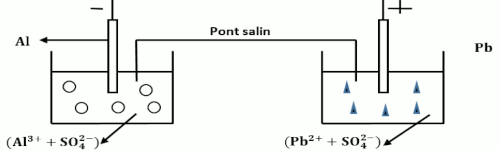 2.3.2. Equation-bilan de la réaction qui se produit lorsque la pile fonctionne : 1,5pt
2.3.2. Equation-bilan de la réaction qui se produit lorsque la pile fonctionne : 1,5pt
\(E_{Al - Pb}^o = {E^o}(P{b^{2 + }}/Pb) - \) \({E^o}(A{l^{3 + }}/Al) = 1,79V\)
La réaction est totale car \(E_{Al - Pb}^o \succ 0,3V\)
2.4 Équation de la polymérisation de l’éthylène \({H_2}C = C{H_2}\)
\(n\left[ {{H_2}C = C{H_2}} \right] \to \) \({\left[ { - {H_2}C - C{H_2} - } \right]_n}\)
Exercice 3 : Utilisation des savoirs / 8 pts
3.1 Équilibre de l’équation ci-dessous à l’aide des nombres d’oxydation. 1pt
\({H_2}S + S{O_2} \to \) \(S + {H_2}O\)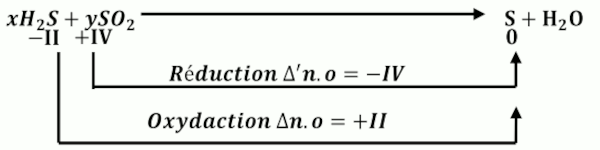 \(x\Delta n.o + y\Delta 'n.o\) \( = x\left( { + II} \right) + \) \(y\left( { - IV} \right) = 0\)
\(x\Delta n.o + y\Delta 'n.o\) \( = x\left( { + II} \right) + \) \(y\left( { - IV} \right) = 0\)
Soit \(x = 1\) et \(y = 2\)
\(2{H_2}S + S{O_2} \to \) \(3S + {H_2}O\)
3.2. Données : \({m_{Zn}} = 3,5g\); acide chlorhydrique : C = 0,1mol/L ; V = 100mL
3.2.1.- Demi-équations électroniques des couples \({H_3}{O^ + }/{H_2}\) et \(Z{n^{2 + }}/Zn\). 1pt
\(Zn \to Z{n^{2 + }} + 2{e^ - }\)
\(2{H_3}{O^ + } + 2{e^ - } \to \) \({H_2} + 2{H_2}O\)
3.2.2. Déduire de l’équation-bilan de la réaction. 1pt
\(2{H_3}{O^ + } + Zn \to \) \(Z{n^{2 + }} + {H_2} + 2{H_2}O\)
3.2.3. Masse de zinc en excès.
- Calcule de la masse de zinc ayant réagi :
\({n_{Zn}} = \frac{{{n_{{H_3}{O^ + }}}}}{2} \Rightarrow \) \({m_{Zn}}_{(reagit)} = \frac{{{M_{Zn}}C.V}}{2}\) \( = 0,327g\) 0,25ptx2
\({m_{Zn}}_{(exces)} = {m_{Zn}} - {m_{Zn}}_{(reagit)}\) \( = 3,5 - 0,327 = 3,173g\) 0,25pt
3.2.4. Calcule de la masse du produit anhydre de chlorure de zinc ainsi récupérée : 1pt
\(Zn + C{l_2} \to ZnC{l_2}\)
\({m_{ZnC{l_2}}} = \) \(\frac{{{m_{Zn(reagit)}}.{M_{ZnC{l_2}}}}}{{{M_{Zn}}}}\) \( = 2,08g\)
3.3. Données : \(S{O_2}\) : \(Vr = 20c{m^3}\); \(MnO_4^ - \): C = 0,1 mol/l, \(Ve = 20c{m^3}\)
3.3.1) Equation-bilan équilibrée du dosage. 1pt
\(MnO_4^ - + 8{H_3}{O^ + } + 5{e^ - }\) \( \Leftrightarrow M{n^{2 + }} + 12{H_2}O\) : x2
\(S{O_2} + 6{H_2}O \Leftrightarrow \) \(SO_4^{2 - } + 4{H_3}{O^ + } + 2{e^ - }\) :x5
Soit l’equation bilan
\(2MnO_4^ - + 5S{O_2}\) \( + 6{H_2}O \Leftrightarrow 2M{n^{2 + }}\) \( + 5SO_4^{2 - } + 4{H_3}{O^ + }\)
3.3.2. Concentration Cr : 2pt
\(\frac{n}{2} = \frac{{{n_r}}}{5} \Leftrightarrow \) \(\frac{{CVe}}{2} = \frac{{CrVr}}{5} \Rightarrow \) \(Cr = \frac{2}{5}\frac{{CrVr}}{{CVe}}\)
Alors \(Cr = 0,15mol/l\)1 pt
PARTIE B : EVALUATION DES COMPETENCES / 16pts
Identification du problème : il est question ici de dire si papa Abe soufre du diabète ou pas. 1pt
Pour cela, nous allons :
a) Calculer masse de glucose contenue dans le sang prélevé ; 2pts
b) Calculer la concentration massique du glucose dans le sang ; 1pt
c) Faire la comparaison ; 1pt
d) Conclure. 1pt
Résolution :
a) \(\frac{{{m_{C{u_2}O}}}}{{{M_{C{u_2}O}}}} = \frac{{{m_{R - CHO}}}}{{{M_{R - CHO}}}} \Rightarrow \) \({m_{R - CHO}} = {M_{R - CHO}}.\frac{{{m_{C{u_2}O}}}}{{{M_{C{u_2}O}}}}\) 2pts
A.N: \({m_{R - CHO}} = 7,5mg\). 2pts
b) \(Cm = \frac{m}{V} = \frac{{7,5}}{{12}}\) \( = 0,625g/L\) 1pt
On a donc : \(Cm = 625mg/L\). 2pts
c) Comparaison : \(180mg/L \prec 625mg/L\) 2pts
d) Conclusion : papa Levi souffre du diabète. 1pt
Correction proposée par le professeur Belvinard POUADJEU

