Partie A : Évaluation des ressources / 12 points
Exercice 1 : vérification des savoirs / 4 pts
1. Définition :
Compos aromatique : Composé renfermant le noyau benzénique dans sa structure. 0,75 pt
Réaction de Fridel et Crafts : Réaction au cours de laquelle un halogénure d’alkyle réagit avec le benzène pour donner un alkylbenzène. 0,75 pt
2. formule semi-développée du benzène 1 pt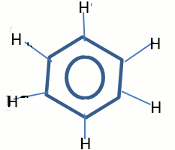 Structure géométrique :
Structure géométrique :
• structure : plane 0,5 pt
• type de liaison C-C : ni simple, ni double 0,5 pt
• angle valenciel : \({120^o}\) 0,5 pt
Exercice 2 : Application des savoirs
1. Détermination de la formule brute :
\({C_n}{H_{2n + 2}} \Rightarrow \) \(M = 12n + 2n\) \( + 2 = 72 \Rightarrow \) \(n = 5\) . 0,75 pt
Formule brute : \({C_5}{H_{12}}\) 0,5 pt
2. Écriture des formules semi-développées \({C_4}{H_{8}}\) 0,5 X 3 = 1,5 pt
\({H_2}C = CH - \) \(C{H_2} - C{H_3}\)
\({H_3}C - CH = \) \(CH - C{H_3}\)
\(\begin{array}{*{20}{c}} {{H_3}C - }&C&{ = C{H_2}}\\ {}&|&{}\\ {}&{C{H_3}}&{} \end{array}\)
3.. Nomenclature
• : 4,4-diéthylheptan-3-one
• : pentan-2-ol
Exercice 3 : Utilisation des savoirs
1. Fonctions chimiques possibles de A : aldéhyde ou cétone 0,75 x2 = 1,5 pt
2. Fonction chimique de A : aldéhyde 1 pt
3. Formule semi-développée de A : \(\begin{array}{*{20}{c}} {{H_3}C - }&{CH}&{ - CHO}\\ {}&|&{}\\
{}&{C{H_3}}&{} \end{array}\)
Partie B : Évaluation des compétences / 8 points
1ière méthode
Volume de l’hydrocarbure : 0,125L
Volume de dioxygène du premier laboratoire: 1,2L
1- Identification du problème : On vérifie que le contenu de la bouteille n’est que le butane. 1 pt
2- Méthodologie :
2.1- Détermination du volume du dioxygène nécessaire pour bruler 0,125L de butane. 1 pt
a) Équation – bilan de la combustion du butane : 2 pts
\({C_4}{H_{10}} + \frac{{13}}{2}{O_2}\) \( \to 4C{O_2} + \) \(5{H_2}O\)
\(2{C_4}{H_{10}} + 13{O_2}\) \( \to 8C{O_2} + 10{H_2}O\)
b) Calcule : \(\frac{{{n_{{C_4}{H_{10}}}}}}{2} = \frac{{{n_{{O_2}}}}}{{13}}\) \( \Rightarrow {V_{{O_2}}} = \) \(\frac{{13{V_{{C_4}{H_{10}}}}}}{2}\)
AN : \({V_{{O_2}}} = 0,81L\) 2 pts
2.2- Comparaison du volume nécessaire et le volume du dioxygène du premier laboratoire.
0,8125L < 1,2L 1 pt
3. Conclusion : Le rapport du premier laboratoire est juste. C’est-à-dire que la bouteille contient en plus du butane un autre gaz. 1 pt
2ième méthode
Volume de l’hydrocarbure : 0,125L
Volume de dioxygène du premier laboratoire: 1,2L
1- Identification du problème : On vérifie que le contenu de la bouteille n’est que le butane. 1 pt
2- Méthodologie :
2.1- Détermination du volume de butane brulé par 1,2L de dioxygène. 1 pt
a) Équation – bilan de la combustion du butane
\(2{C_4}{H_{10}} + 13{O_2}\) \( \to 8C{O_2} + 10{H_2}O\)
b) Calcule : \(\frac{{{n_{{C_4}{H_{10}}}}}}{2} = \frac{{{n_{{O_2}}}}}{{13}}\)
A.N : \({V_{{C_4}{H_{10}}}} = 0,0,187L\)
2.2- Comparaison du volume butane brulé par 1,2L de dioxygène et le volume du butane du gaz dans la bouteille. 0,187L > 0,125L 1 pt
3. Conclusion : Le rapport du premier laboratoire est juste. C’est-à-dire que la bouteille contient en plus du butane un autre gaz. 1 pt

