I Généralités
Les composés organiques comportant au sein de leur molécule le groupe carbonyle sont appelés composés carbonylés.
\(\begin{array}{*{20}{c}} {}&O&{}\\{}&{||}&{}\\ - &C& - \end{array}\)
Le groupe carbonyle
La formule générale des composés carbonylés à chaine carbonée saturée est : \({C_n}{H_{2n}}O\)
Deux classes fonctionnelles correspondent aux composés carbonylés :
• Les aldéhydes comportent le groupe caractéristique (ou groupe fonctionnel) \( - COH\). Le groupe carbonyle est lié à un groupe alkyle ou phényle et un atome d'hydrogène (exceptionnellement deux atomes d'hydrogène dans le cas du méthanal) ;
La structure générale des cétones est :
\(\begin{array}{*{20}{c}}{}&{}&O&{}&{}\\{}&{}&{||}&{}&{}\\R& - &C& - &H\end{array}\)
• Les cétones comportent le groupe caractéristique \( - CO - R\). Le groupe carbonyle est lié à des groupes alkyles ou phényles.
La structure générale des cétones est :
\(\begin{array}{*{20}{c}} {}&{}&O&{}&{}\\{}&{}&{||}&{}&{}\\R& - &C& - &{R'}\end{array}\)
II. Nomenclature
II.1 Des aldéhydes
Il convient de distinguer les aldéhydes acycliques et cycliques.
• Les aldéhydes acycliques
La fonction aldéhyde est ce que l’on appelle une fonction « terminale » (obligatoirement en fin de chaîne, rien ne pouvant venir après -CO-H). Le carbone de la fonction fait obligatoirement partie de la chaîne principale et sera numéroté 1, la numérotation est ensuite poursuivie sur la chaîne linéaire la plus longue de carbones.
Le nom ne fait pas apparaître l’indice 1 pour la fonction, car cette précision est toujours superflue, cet indice étant toujours 1.
Le nom d’un aldéhyde s’obtient en remplaçant le « e » final du nom de l’alcane dont il dérive par «al », On numérotera donc la chaine carbonée dans le cas des aldéhydes en commençant par le carbone fonctionnel.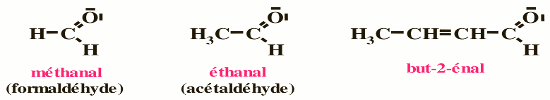 Pour les composés polyfonctionnels, on utilise les suffixes dial et trial. Si le groupe CHO est prioritaire dans un composé polyfonctionnel, il porte le numéro 1.
Pour les composés polyfonctionnels, on utilise les suffixes dial et trial. Si le groupe CHO est prioritaire dans un composé polyfonctionnel, il porte le numéro 1.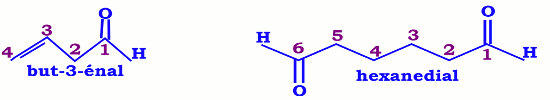 • Les aldéhydes cycliques
• Les aldéhydes cycliques
Lorsque le groupe CHO est fixé sur un atome de carbone faisant partie d'un système cyclique non aromatique, on ajoute la terminaison carbaldéhyde au nom du système cyclique.
Lorsque le groupe CHO est fixé sur un cycle benzénique, le composé est nommé comme dérivé du benzaldéhyde.
II.2 Des cétones
Comme dans le cas précédent, on distingue les séries cyclique et acyclique.
• Les cétones acycliques
Le nom d’une cétone dérive de celui de l’alcane correspondant en remplaçant le «e » de l’alcane par « -one ». La chaîne principale est la plus longue des chaînes contenant un groupement le groupement (C=O). Le suffixe one , éventuellement muni de son préfixe multiplicatif , est précédé de l 'ensemble des indices des atomes de carbone portant un atome d' oxygène doublement lié , séparés par une virgule , l 'ensemble étant mis entre tirets.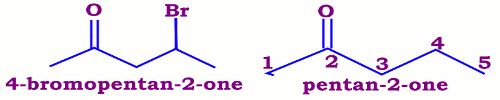 NB : Dans le cas où le groupe carbonyle n'appartient pas à la chaîne principale. Le substituant \({H_3}C - CO - \) est désigné par acétyle.
NB : Dans le cas où le groupe carbonyle n'appartient pas à la chaîne principale. Le substituant \({H_3}C - CO - \) est désigné par acétyle.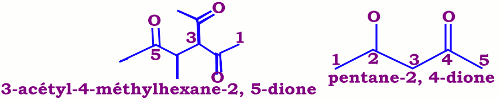 • Les cétones cycliques
• Les cétones cycliques
Le nom peut être formé suivant le schéma : substituant nom du cycle sans le « e » final suffixe « one ». On utilise l'ordre alphabétique pour énoncer les groupes qui sont précédés éventuellement de di, tri etc.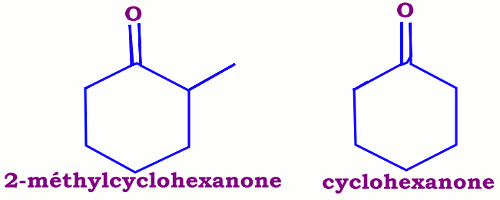 III Propriétés physiques
III Propriétés physiques
Les aldéhydes et les cétones sont moins volatiles que les alcanes dont ils dérivent. Les aldéhydes et les cétones à chaine carbonée pas très longue sont polaires donc solubles dans l’eau.
IV- Propriétés chimiques
IV-1-Propriétés communes aux aldéhydes et cétones.
Les aldéhydes et cétones en présence de la 2,4-D.N.P.H. donnent un précipité jaune mettant en évidence la présence du groupe carbonyle.
IV-2-Propriétés spécifiques aux aldéhydes
IV-2-1- Les test au réactif de Schiff.
Les cétones sont sans action sur le réactif de Schiff alors que les aldéhydes le rosissent. Ce test permettant de distinguer les aldéhydes des cétones n’est pas toujours fiable contrairement aux tests basés sur leurs propriétés réductrices.
Le test au réactif de Schiff doit se faire dans un tube à essai plongé dans un cristallisoir rempli de glace afin de décolorer le réactif de Schiff qui est rose à température ambiante.
IV-2-2-Propriétés réductrices des aldéhydes.
La propriété réductrice est la propriété chimique qui permet de distinguer les aldéhydes des cétones.
Les aldéhydes sont oxydés par des oxydants forts tels que dichromate de Potassium et le permanganate de potassium en milieu acide (acide carboxylique). Ils sont également oxydés par des oxydants doux tels que le nitrate d’argent ammoniacal (réactif de Tollens) ou la liqueur de Fehling, soit en acide carboxylique en milieu acide soit en ion carboxylate en milieu basique.
IV-2-2-1-Réduction du réactif de Tollens.
Lorsque le test est positif, on obtient un dépôt d’argent appelé miroir d’argent.
Préparation du réactif de Tollens : A une solution de nitrate d’argent, on ajoute une solution d’ammoniac, il se forme un précipité brun d’oxyde d’argent qui se dissout dans un excès d’ammoniac par suite de formation de l’ion diamine argent I.
Test au nitrate d’argent ammoniacal : Dans un tube à essai parfaitement propre, introduisons quelques \(c{m^3}\) de réactif Tollens, puis environs 1 \(c{m^3}\) d’un aldéhyde (RCHO).
Agitons et plaçons le tube dans un bain-marie à 50°C environ ; le mélange noircit progressivement, et un dépôt brillant se forme sur les parois du tube à essais : c’est de l’argent métallique.
Les demi-équations de réaction sont :
\(RCHO + 3O{H^ - }\) \( \to R - CO{O^ - }\) \( + 2{H_2}O + 2{e^ - }\)
\(2(Ag(NH3)_2^ + \) \( + 2{e^ - } \to \) \(2Ag + 4N{H_3}\)
L’équation bilan devient :
\(RCHO + 3O{H^ - }\) \( + 2Ag(N{H_3})_2^ + \) \( \to R - CO{O^ - }\) \( + 2{H_2}O + 2Ag + \) \(4N{H_3}\)
NB : Cette réaction était utilisée pour argenter la face d’un miroir.
IV-2-2-2-Réduction de la liqueur de Fehling.
Lorsque le test est positif, on obtient un précipité rouge brique.
Préparation de la liqueur de Fehling.
Dans quelques \(c{m^3}\) de solution de sulfate de cuivre(II), versons progressivement une solution basique contenant les ions tartrate, il se forme tout d’abord un précipité bleu clair d’hydroxyde de cuivre(II) qui se dissout dans un excès de solution de tartrate(acide dicarboxylique de formule semi-développée \(^ - OOC - \) \({\left( {CHOH} \right)_2} - CO{O^ - }\)), en donnant une solution limpide dont la couleur bleu roi est due à l’ion complexe \(C{u^{2 + }}_{tar}\) . Cette solution est appelée liqueur de Fehling.
Test à la liqueur de Fehling.
A quelques \(c{m^3}\) de la liqueur de Fehling, ajoutons environ 1 \(c{m^3}\) d’un aldéhyde, par exemple l’éthanal. Chauffons doucement à la flamme ; le mélange passe par une teinte verdâtre, puis un précipité rouge brique se forme : c’est l’oxyde de cuivre(I).
N.B : Si l’aldéhyde utilisé est le méthanal, il peut éventuellement se former un dépôt de cuivre métallique brillant sur les parois du tube à essais : la réduction du cuivre(II) est alors poussée jusqu’au cuivre(0).
Les demi-équations de réaction sont :
\(RCHO + 3O{H^ - }\) \( \to R - CO{O^ - }\) \( + 2{H_2}O + 2{e^ - }\)
\(2C{u^{2 + }} + 2O{H^ - }\) \( + 2{e^ - } \to \) \(C{u_2}O + {H_2}O\)
L’équation bilan devient :
\(RCHO + \) \(5O{H^ - } + 2C{u^{2 + }}\) \( \to R - CO{O^ - }\) \( + C{u_2}O + \) \(3{H_2}O\)
Cette réaction était utilisée pour doser le glucose dans les urines.
NB : Le glucose de formule \(HO - C{H_2} - \) \({(CHOH)_4} - CHO\) est un sucre réducteur car possède la fonction aldéhyde qui est réductrice alors que le fructose de formule \(HO - {(C{H_2})_4} - \) \(CO - C{H_2} - OH\) n’est pas un sucre réducteur car possède plutôt la fonction cétone.


