Ce cours apporte les éléments qui permettront aux élèves d’aborder sereinement l’examen de travaux pratique de chimie.
Avant d’égrener les consignes à respecter dans un laboratoire, définissons d’abord la chimie et ensuite donnons les qualités d’un bon chimiste.
La chimie est la science qui étudie la constitution, les propriétés et les transformations de la matière.
Les qualités d’un bon chimiste sont : l’ordre, la propreté, le calme
La manipulation dans un laboratoire de chimie nécessite de connaitre le matériel et de respecter des règles de sécurité.
1-Consignes de base
- Travailler sur une paillasse propre et bien dégagé
-Manipuler debout, au dessus de la paillasse, avec les sièges rangés en dessous
-Pour toute manipulation, porter la blouse en coton toujours boutonnée et des lunettes de protection.
-En cas d’utilisation de produit corrosif ou toxique, porter des gants
-En cas d’utilisation de produit inflammable, éloigner toute source de chaleur (chauffe-ballon, plaque chauffante, flamme….)
2-La manipulation de produits chimiques
-Avant d’utiliser un produit chimique, lire l’étiquette et respecter les consignes de sécurité indiquées sur les pictogrammes de danger et les codes R et S.
-Ne prélever aucun solide avec les doigts ; utiliser une spatule
-Ne jamais pipeter de réactif avec la bouche ; toujours utiliser une pipette munie d’une poire, d’une tétine, d’une propipette ou d’un pipeteur. Toujours reboucher le flacon après usage.
-Enfin de manipulation, ne pas jeter les solutions dans l’évier mais utiliser les bacs de récupération lorsque ceux-ci existent. Danger : la plupart de produit chimique étant corrosif, ils risquent d’oxyder l’évier qui est en fer ou en aluminium. Toujours diluer les solutions rejetées à l’évier, en laissant couler l’eau quelques instants.
-Verser les produits du coté opposé à l’étiquette.
-Etiqueter convenablement tout récipient contenant des produits chimiques
-Ne jamais verser de l’eau dans un acide concentré mais toujours de l’acide dans l’eau car il y risque de projection de l’acide avec pour conséquence des brûlures.
-Ne jamais ajouter de la pierre ponce dans un liquide chaud.
3. Comportements interdits au laboratoire
-Boire -Manger -Courir -Pipeter à la bouche -Prélever un solide avec les doigts -Diriger un tube à essai chauffé vers soi même ou vers ces camarades -Distiller à sec -Reconnaitre un produit par son odeur –Utiliser un produit inflammable à côté d’une source de chaleur.-Lancer un objet.
4. Conduite à tenir en cas de problèmes
Quelque soit la situation qui se présenterait au laboratoire, il faut toujours : garder son sang froid, rester calme, ne pas paniquer, agir avec rapidité et surtout effectuer le bon geste qui sera ci-dessous donné.
1. Difficulté rencontrée en laboratoire
Produit avalé
2. Règle de sécurité
-interdit de pipeter à la bouche
-utiliser les propipettes et les tétines
3. Gestes de première urgence
-Rincer la bouche
-Ne pas faire boire
-Ne pas faire vomir
1. Difficulté rencontrée en laboratoire
Projection dans l’œil
2. Règle de sécurité
-Utiliser les lunettes de protection
3. Gestes de première urgence
-Rincer l’œil maintenu ouvert sous un filet d’eau froide ou tiède, tête penchée, œil contaminé en dessous de l’œil sain.
1. Difficulté rencontrée en laboratoire
Brûlure thermique
2. Règle de sécurité
- Éviter les cheveux qui flottent au vent, ni vêtements flottants
- Pas de vêtement synthétiques
- Porter une blouse en coton
3. Gestes de première urgence
-Rincer immédiatement sous un filet d’eau froide, environ 15 minutes.
-Garder les vêtements collés à la peau
1. Difficulté rencontrée en laboratoire
Brûlure chimique
2. Règle de sécurité
-Porter une blouse
-Utiliser les concentrations minimales nécessaires
-Étiqueter les contenants
-Utiliser les gants si nécessaire
3. Gestes de première urgence
- Rincer immédiatement sous un filet d’eau froide,
-Enlever les vêtements contaminés sans toucher le visage
1. Difficulté rencontrée en laboratoire
Incendie
2. Règle de sécurité
-Paillasse rangée
-Savoir utiliser l’extincteur, la serpillère mouillée et la couverture anti feu
3. Gestes de première urgence
- feu est sur la paillasse : utiliser l’extincteur à CO2 et attaquer les flammes par la base
-Sur une personne : utiliser la couverture antifeu et/ou l’extincteur
1. Difficulté rencontrée en laboratoire
Inhalation d’un gaz irritant ou toxique
2. Règle de sécurité
-Travailler sous une hotte
-Produire les quantités minimales de gaz
3. Gestes de première urgence
-Faire sortir et respirer de l’air frais
1. Difficulté rencontrée en laboratoire
Projection sur le corps
2. Règle de sécurité
-Utiliser la blouse en coton
-Ne pas introduire de la pierre ponce dans un liquide chaud.
3. Gestes de première urgence
- Utiliser immédiatement la douche de sécurité pour se laver abondamment à l’eau et ôter aussitôt ses vêtements.
1. Difficulté rencontrée en laboratoire
Produits versés
2. Règle de sécurité
-Paillasse rangée
-Savoir utiliser du papier absorbant
3. Gestes de première urgence
-sol ou paillasse contaminés par un produit peu toxique, peu volatile : nettoyer en utilisant du papier absorbant. S’il s’agit d’un acide ou d’une base, neutraliser avant de nettoyer.
-si la substance est volatile, inflammable ou toxique et la quantité importante, il faut couper le courant électrique et quitter le laboratoire.
4. Les pictogrammes et leurs significations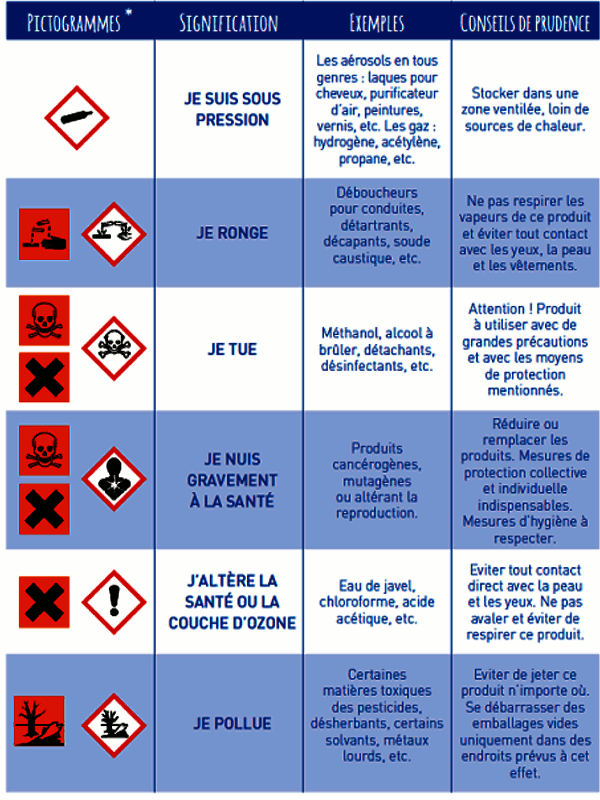 5-MATERIEL DE LABORATOIRE ET RÔLE.
5-MATERIEL DE LABORATOIRE ET RÔLE.
a -La spatule : pour prélever un solide (cristaux)
b-Capsule en verre et verre de montre: pour contenir les solides à peser.
c-Propipette ou poire, pipeteur et tétine : utiliser pour aspirer en toute sécurité les liquides à travers une pipette.
d-Fioles jaugées: pour prépare un volume bien déterminer de solution, pour mesurer avec précision un grand volume de solution ou d’eau.
e-Entonnoirs à solide et à liquide : Pour introduire un solide ou un liquide dans une fiole.
f-Entonnoir Büchner : intervient dans la filtration sous vide
g-Pissette d’eau distillée : Pour dissoudre les solides, diluer les liquides, rincer les capsules et les entonnoirs, bref permet l’usage de petites quantités de volume.
h-Bécher : sert à placer le liquide à pipeter pour un prélèvement, à contenir une solution à doser et à recueillir les filtrats et distillats.
i-Pipettes jaugées à un trait ou à deux traits : pour prélever et distribuer un volume précis de solution. Pour utiliser une pipette jaugée à deux traits, il faut prélever le liquide jusqu’au trait supérieur de jauge et pour le distribuer, le laisser couler jusqu’au trait inférieur de jauge.
j-Pipettes graduées : pour prélever des volumes précis qui ne peuvent l’être avec pipettes jaugées (8,5 ml par exemple)
k-Pipettes simples : pour finir de compléter une fiole jaugée jusqu’au trait de jauge.
l-éprouvettes graduées : pour mesurer approximativement un volume de liquide.
m-Erlenmeyers : sert à placer le liquide à pipeter pour un prélèvement, à contenir une solution à doser et à recueillir les filtrats et distillats.
n-Agitateur en verre : pour agiter ou homogénéiser des solutions contenues dans des béchers ou tubes à essai
o-Fiole à vide : pour réaliser la filtration sous vide ou sur Büchner.
p-Réfrigérant : permet le refroidissement et la condensation des vapeurs
q-L’ampoule à décanter : permet de séparer un mélange non miscible de deux solutions et de réaliser l’extraction par solvant.
-Pour séparer deux liquides non miscibles, il faut introduire le mélange dans l’ampoule, laisser reposer pendant plusieurs minutes jusqu’à ce que les deux phases se forment, ouvrir le robinet pour laisser le liquide le plus dense s’écouler. Le refermer lorsque la surface de séparation des deux liquides a atteint le robinet. Elle est récupérée dans un bécher.
-Pour extraire par un solvant un composé E dissous dans un autre solvant (généralement l’eau) : dans l’ampoule à décanter, on introduit le mélange aqueux et le solvant S qui n’est miscible à l’eau et dans lequel l’espèce E est très soluble. On agite l’ensemble dans l’ampoule
à décanter, en effectuant, de temps à autre, un dégazage. On laisse reposer, deux phases liquides apparaissent. Ouvrir le robinet pour laisser le liquide le plus dense s’écouler. Le refermer lorsque la surface de séparation des deux liquides a atteint le robinet. Elle est récupérée dans un bécher.
q-Le bain–marie : permet de faire un chauffage à température constante.
r-L’étuve : permet de sécher et de stériliser le matériel de verrerie
s-Le banc chauffant de Köfler : appareil servant à déterminer les points de fusion des solides cristallisés
t-Noix : pièces en métal ou en plastique utilisées pour fixer les pinces sur les supports
u-Pinces : pièces de fixation employées dans le maintien en position des éléments d’un montage ou d’une expérience.
v-Dessiccateur : récipient en verre utilisé pour sécher les composés solides.
x-Chauffe-ballon : appareil électrique utilisé pour chauffer le ballon.
y-Ballon : récipient en verre permettant de contenir le mélange à chauffer lors de la distillation ou d’un chauffage à reflux.
z-La colonne vigreux : permet de conduire les gaz du ballon vers le réfrigérant.
-La pierre ponce permet de réguler l’ébullition
-La hotte aspirante permet la manipulation en toute sécurité des composés volatiles toxiques et dangereux en les évacuant hors du laboratoire.
-Mortier avec pilon : sert à écraser des composés solides
-Agitateur magnétique : sert à homogénéiser les mélanges de solution ou de faciliter la dissolution.
-Chauffage à reflux sert à augmenter la vitesse d’une réaction sans perte de matière
-Montage à reflux sert à porter à ébullition un mélange réactionnel sans perte de matière.
6. La préparation des solutions
6.1. Dissolution d’un soluté solide
1-En utilisant la relation \(m = CMV\), calculer la masse m de soluté de masse molaire M à dissoudre.
2-Choix du matériel : -fiole jaugée de contenance V égale au volume de la solution à préparer
- L’entonnoir à solide – le verre de montre ou la capsule en verre - la balance de précision
– la pissette -la spatule
3- Choix des réactifs
- Cristaux de sel de soluté
- Eau distillée
4-Mode opératoire ou préparation.
Sur la balance tarée sur laquelle repose le verre de montre, mesurer la masse m de soluté préalablement prélevée grâce à la spatule. Introduire cette masse dans la fiole jaugée de volume V à l’aide l’entonnoir à solide remplie à moitié d’eau distillée. Rincer le verre de montre et l’entonnoir à solide et veiller à récupérer les eaux de rinçage dans la fiole jaugée.
Boucher la fiole, puis l’agiter jusqu’à la dissolution complète du solide. Compléter le volume au trait de jauge avec de l’eau distillée de la pissette. Boucher la fiole et homogénéiser. Laver le matériel et le ranger.
6.2 Dissolution d’une solution mère
1-Calculer du volume V0 de solution mère de concentration C0 à prélever, en utilisant la relation \({V_0} = \frac{{CV}}{{{C_0}}}\) dans laquelle C et V représentent respectivement la concentration et le volume de la solution à préparer.
2-Choix du matériel : - fiole jaugée de volume V – pipette jaugée de volume V0 si la valeur n’a pas de partie décimal, une pipette graduée si elle en y a. (Par exemple : une pipette graduée de 10 ml lorsque V0 = 6,7 ml)
3- Choix des réactifs
-Solution mère de concentration C0
-Eau distillée
4-Mode opératoire ou préparation
Pipeter le volume V0 de la solution mère à l’aide de la pipette jaugée de volume V0, introduire ce volume dans la fiole jaugée de volume V à moitié remplie d’eau distillée.
Homogénéiser. Compléter le volume au trait de jauge avec de l’eau distillée de la pissette.
Homogénéiser. Laver le matériel et le ranger.


