Objectifs :
- Définir et distinguer les classes d’alcools.
- Connaître les réactions caractéristiques des alcools.
1. Généralités
1.1 Définition
Les alcools sont des composés organiques oxygénés constitués d’un groupement hydroxyle –OH lié à un atome de carbone ne formant que des liaisons de covalences simples avec d’autres atomes de carbones ou d’hydrogènes.
Le groupe –OH est appelé groupe caractéristique ou groupe fonctionnel des alcools. L’atome de carbone portant le groupe -OH est appelé carbone fonctionnel.
Remarque :
- Un groupe –OH fixé sur un atome de carbone ne donne pas nécessairement un alcool
exemple :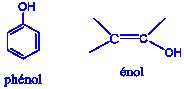 - La formule statistique (formule brute) des alcools provient de celle des alcanes sur la quelle a été substitué un atome d’hydrogène par un groupement (-OH), ainsi, la formule brute des alcanes étant \({C_n}{H_{2n + 2}}\), celle des alcools est \({C_n}{H_{2n + 1}} - OH\) ou \({C_n}{H_{2n + 2}}O\).
- La formule statistique (formule brute) des alcools provient de celle des alcanes sur la quelle a été substitué un atome d’hydrogène par un groupement (-OH), ainsi, la formule brute des alcanes étant \({C_n}{H_{2n + 2}}\), celle des alcools est \({C_n}{H_{2n + 1}} - OH\) ou \({C_n}{H_{2n + 2}}O\).
1.2 Nomenclature des alcools
En nomenclature systématique, le nom d’un alcool est obtenu en remplaçant le « e » final du nom de l’alcane dont il dérive (même chaine carboné) par la terminaison « ol ». Le suffixe « ol » est généralement précédé d’un tiret et du numéro le plus petit possible du carbone fonctionnel.
Exemple 1: Nommons les composés :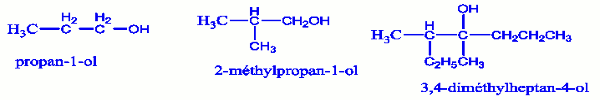
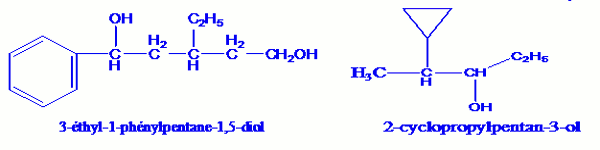 Exemple 2 : Donnons la formule semi-développée des composés de noms :
Exemple 2 : Donnons la formule semi-développée des composés de noms :
a) 2,4-diméthylheptan-3-ol.
b) 4-éthyl-3,6,7-triméthyloctan-4-ol.
c) 2,4,4-triméthylheptan-2-ol.
1.3 Structure du groupe (OH) d’un alcool.
L’atome d’oxygène a pour numéro atomique Z = 8, pour formule électronique K2L6 et pour représentation de Lewis : \(\begin{array}{*{20}{c}}{}& - &{}\\ \bullet &O& \bullet \\{}& - &{}\end{array}\)
L’atome d’oxygène du groupement (OH) peut donc formé deux liaisons de covalences simples. Dans une molécule d’alcool, il est lié à un atome de carbone et à un atome d’hydrogène, les deux liaisons covalentes simples formées font entre elles un angle légèrement supérieur à 90°. Le modèle moléculaire est alors :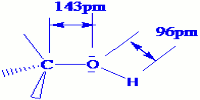 1.4 différentes classes d’alcools
1.4 différentes classes d’alcools
Les différentes classes d’alcools sont définies selon le nombre d' atomes d’hydrogènes liés à l’atome de carbone fonctionnel ou encore selon le nombre de chaine carbonée insaturée porté par le carbone fonctionnel, ainsi donc, on distingue trois classes d’alcools : Les alcools primaires, les alcools secondaires et les alcools tertiaires.
Un alcool est dit primaire si le carbone fonctionnel est lié à deux atomes d’hydrogènes ou encore si le carbone fonctionnel n’est lié qu’à un seul groupe alkyle. La formule générale des alcools primaires est donc :\(R - C{H_2} - OH\), ou R représente un atome d’hydrogène ou un groupe alkyle.
Exemple :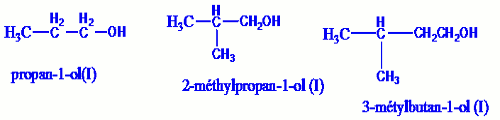 Un alcool est dit secondaire si le carbone fonctionnel est lié à un seul atome d’hydrogène ou encore s’il est lié à deux groupes alkyles. Leur formule générale est donc : \(\begin{array}{*{20}{c}}{}&{}&{R'}&{}&{}\\{}&{}&|&{}&{}\\R& - &C& - &{OH}\\{}&{}&|&{}&{}\\{}&{}&H&{}&{}\end{array}\)
Un alcool est dit secondaire si le carbone fonctionnel est lié à un seul atome d’hydrogène ou encore s’il est lié à deux groupes alkyles. Leur formule générale est donc : \(\begin{array}{*{20}{c}}{}&{}&{R'}&{}&{}\\{}&{}&|&{}&{}\\R& - &C& - &{OH}\\{}&{}&|&{}&{}\\{}&{}&H&{}&{}\end{array}\)
R et R’ représentant les groupes alkyles.
Exemple :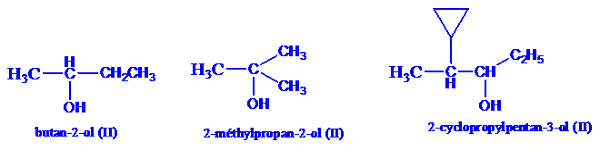 Un alcool est dit tertiaire si le carbone fonctionnel n’est lié à aucun atome d’hydrogène ou encore s’il est lié à 3 groupements alkyles, leur formule générale est donc : \(\begin{array}{*{20}{c}}{}&{}&{R'}&{}&{}\\{}&{}&|&{}&{}\\R& - &C& - &{OH}\\{}&{}&|&{}&{}\\{}&{}&{R''}&{}&{}\end{array}\)
Un alcool est dit tertiaire si le carbone fonctionnel n’est lié à aucun atome d’hydrogène ou encore s’il est lié à 3 groupements alkyles, leur formule générale est donc : \(\begin{array}{*{20}{c}}{}&{}&{R'}&{}&{}\\{}&{}&|&{}&{}\\R& - &C& - &{OH}\\{}&{}&|&{}&{}\\{}&{}&{R''}&{}&{}\end{array}\)
R, R’ et R’’ représentant les groupes alkyles.
Exemple :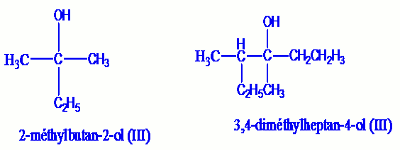 Remarque :
Remarque :
- L’indice de position de groupe (OH) ne donne pas d’information sur la classe de l’alcool sauf pour l’indice 1.
- Si les trois groupes liés au carbone fonctionnel sont différents, on parle de carbone asymétrique et on le note C*.
1.5 propriétés physiques des alcools.
A la température ordinaire et à pression normale, les alcools sont tous liquides ou solides. Ils sont de bons solvants pour les composés organiques. Les alcools sont volatiles et plus solubles dans l’eau que les alcanes correspondants. Les propriétés physiques d’un alcool varient en fonction de sa classe et de la nature de la chaine carbonée.
Exemple : La température d’ébullition d’un alcool décroit de l’alcool primaire à l’alcool tertiaire ou encore de l’alcool à chaine linéaire à l’alcool à chaine ramifié.
Exercice d’application : Écrire les formules semi-développées des alcools isomères de formule brute C5H12O .les classer en alcool primaire, secondaire et tertiaire.
2. Les aldéhydes et les cétones.
Les aldéhydes et les cétones sont des composés organiques oxygénés qui ont pour groupe caractéristique le groupe carbonyle.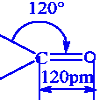 Les aldéhydes et les cétones sont généralement appelés dérivés carbonylés.
Les aldéhydes et les cétones sont généralement appelés dérivés carbonylés.
2.1 Les aldéhydes.
Dans ce cas, l’atome de carbone fonctionnel est lié à un atome d’hydrogène. La formule générale des aldéhydes est donc :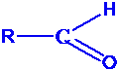 Ou R représente un groupe alkyle ou un autre atome d’hydrogène.
Ou R représente un groupe alkyle ou un autre atome d’hydrogène.
Nomenclature des aldéhydes.
Le nom générique d’un aldéhyde est obtenu en remplaçant le « e » final du nom de l’alcane dont il dérive par la terminaison « al ».
NB : Dans le cas des aldéhydes, le groupement fonctionnel sera toujours en bout de chaine. Son carbone fonctionnel portera toujours l’indice 1.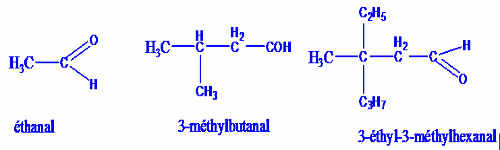 A la température ordinaire, excepté le méthanal, tous les aldéhydes sont des solides et des liquides. Les aldéhydes possèdent un nombre réduit de carbones, ils sont solubles dans l’eau.
A la température ordinaire, excepté le méthanal, tous les aldéhydes sont des solides et des liquides. Les aldéhydes possèdent un nombre réduit de carbones, ils sont solubles dans l’eau.
2.2 les cétones.
Dans le cas des cétones, le groupe carbonyle est lié à deux autres atomes de carbones. Leur formule générale est :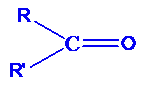 Nomenclature des cétones.
Nomenclature des cétones.
Le nom d’une cétone s’obtient en remplaçant le « e » final de l’alcane dont il dérive par la terminaison « one ». Dans ce cas, le suffixe « one » sera généralement précédé d’un tiret et du numéro le plus petit possible du carbone fonctionnel.
Exemple :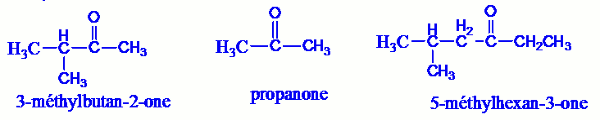 2.3 Propriétés chimiques des aldéhydes et des cétones.
2.3 Propriétés chimiques des aldéhydes et des cétones.
2.3.1 Propriétés communes aux aldéhydes et aux cétones.
La propriété ci-dessous est généralement utilisée pour caractériser les composés carbonylés : Les composés carbonylés donnent tous avec la 2,4-DNPH (dinitrophénylhydrazine) un composé jaune ou orangé. Ce composé est un solide cristallisé appelé 2,4-dinitrophénylhydrazone du composé carbonylé utilisé.
La réaction générale des composés carbonylés sur la 2,4-DNPH est :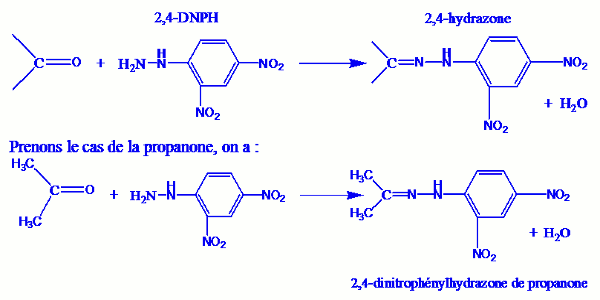 En général, on dit que l’on obtient un test positif par action de la 2,4-DNPH sur les dérivés carbonylés.
En général, on dit que l’on obtient un test positif par action de la 2,4-DNPH sur les dérivés carbonylés.
2.3.2 Propriétés spécifiques aux aldéhydes.
Contrairement aux cétones les aldéhydes présentent un caractère réducteur. Ils peuvent alors être oxydés par certains oxydants doux tel que la liqueur de Fehling, le réactif de shiff, le nitrate d’argent ammoniacal encore appelé réactif de tollens.
• Réaction avec la liqueur de Fehling.
La liqueur de Fehling de couleur bleue foncée contient en solution aqueuse les ions cuivriques Cu2+. En présence d’un aldéhyde et après passage du mélange sur une flamme douce, on observe la formation d’un précipité rouge brique appelé oxyde de cuivre I Cu2O. Le nombre d’oxydation du cuivre passant de 2 à 1, on peut conclure que ce dernier est réduit par l’aldéhyde qui s’oxyde.
Les demi-équations électroniques sont dans le cas ou l’aldéhyde utilisé est l’éthanal : Cu2+/Cu2O ; CH3COOH/CH3COH.
\(2C{u^{2 + }} + {H_2}O\) \( + 2{e^ - } \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} C{u_2}O\) \( + 2{H^ + }\)
\(C{H_3}COH + {H_2}O\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} C{H_3}COOH\) \( + 2{H^ + } \) \(+ 2{e^ - }\)
Équation bilan
\(C{H_3}COH + 2C{u^{2 + }}\) \( + 2{H_2}O \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(C{H_3}COOH + C{u_2}O\) \( + 4{H^ + }\)
La réaction ayant lieu en milieu basique, on doit avoir les ions -OH et sachant que ' \({H^ + } + O{H^ - }\) \( \to {H_2}O\), on peut ajouter \(4O{H^ - }\) dans chaque membre de l'équation bilan on a alors
\(C{H_3}COH + 2C{u^{2 + }}\) \( + 4O{H^ - } \to \) \(C{H_3}COOH + C{u_2}O + 2{H_2}O\)
NB : Cette réaction n’est pas possible avec les cétones.
• Réaction avec le réactif de Tollens.
Le réactif de Tollens encore appelé nitrate d’argent ammoniacal est un liquide incolore contenant les ions diamine argent I de formule [Ag(NH3)2]+.
Lorsque l’on chauffe au bain marie à 80°C dans un ballon, un mélange de nitrate d’argent ammoniacal et d’éthanal, on obtient après agitation un dépôt d’argent qui adhère sur le verre formant ainsi un miroir d’argent.
Le nombre d’oxydation de l‘argent passant de 1 à 0, on dit que l’argent est réduit par l’aldéhyde qui s’oxyde. Les demi-équations électroniques qui ont lieu sont dans le cas ou l’aldéhyde utilisé est le l’éthanal : [Ag(NH3)2]+/Ag ; CH3COO-/CH3COH.
\(2({[Ag{(N{H_3})_2}]^ + }\) \( + {e^ - } \to \) \(2Ag + 2N{H_3})\)
\(C{H_3}COH + {H_2}O\) \( \to C{H_3}CO{O^ - }\) \( + 3{H^ + } \) \(+ 2{e^ - }\)
Équation bilan
\(C{H_3}COH + {H_2}O\) \( + 2{[Ag{(N{H_3})_2}]^ + }\) \( \to 2Ag + 2N{H_3} + C{H_3}CO{O^ - } + 3{H^ + }\)
la réaction ayant lieu en milieu basique, on a:
\(C{H_3}COH + 3O{H^ - }\) \( + 2{[Ag{(N{H_3})_2}]^ + }\) \( \to 2Ag + 2N{H_3}\) \( + C{H_3}CO{O^ - } + \) \(2{H_2}O\)
NB : Cette réaction n’a pas lieu avec les cétones.
• Action avec le réactif de schiff
Le réactif de schiff encore appelé fuchsine est un colorant rose décoloré par le SO2. Le réactif de schiff donne avec un aldéhyde à froid un composé rose violacé.
En général, les cétones ne réagissent pas avec le réactif de schiff.
En résumé, le caractère réducteur des aldéhydes permet de les distinguer des cétones.
En pratique, les oxydants utilisés pour les caractériser sont la liqueur de Fehling et le réactif de Tollens qui ne réagissent pas sur les cétones.
3. Propriétés chimiques des alcools.
3.1 Réduction des alcools par le sodium.
Dans un tube à essai contenant de l’éthanol, introduisons un morceau de sodium dans un excès d’éthanol. Nous observons un dégagement de dihydrogène et la formation d’un produit qui reste partiellement dissous dans l’éthanol. Si l’on évapore l’excès d’alcool, on obtient un solide de couleur blanche appelé éthanolate de sodium. Les demi-équations et l’équation bilan de la réaction sont alors: Na+/Na ; C2H5OH/C2H5O-
\(Na \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} N{a^ + } + {e^ - }\)
\(2{C_2}{H_5}OH + 2{e^ - }\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2{C_2}{H_5}{O^ - } + {H_2}\)
Équation bilan
\(2{C_2}{H_5} - OH + \) \(2Na \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(2{C_2}{H_5}{O^ - } + {H_2}\) \( + 2N{a^ + }\)
Tous les alcools peuvent réagir avec le sodium, dans ce cas l’alcool est réduit en ion alcoolate et en dihydrogène.
3.2 Déshydratation des alcools.
Selon les conditions expérimentales, l’alcool se déshydrate pour former :
- Un alcène on parle dans ce cas de déshydratation intramoléculaire
- Un éther oxyde on parle dans ce cas de déshydratation intermoléculaire.
Application : Cas du propan-1-ol :
o Déshydratation intramoléculaire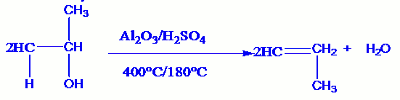 o Déshydratation intermoléculaire.
o Déshydratation intermoléculaire.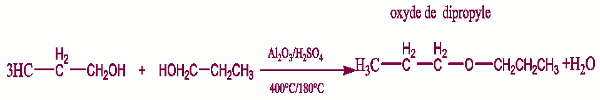 Remarque :
Remarque :
Les éther-oxydes de formule R-O-R’ ou R et R’ sont des groupes alkyles sont des isomères des alcools. Ils ont généralement même formule brute mais diffèrent par leurs fonctions, on parle ici d’isomérie de fonction.
3.3 Réaction d’oxydation des alcools.
Il existe deux types d’oxydations :
- L’oxydation vive encore appelé combustion au cours de la quelle il y’ a destruction de la chaine carbonée des alcools
- L’oxydation ménagée au cours de la quelle il n’ya pas destruction de la chaine carbonée.
La combustion totale
\({C_n}{H_{2n + 2}} + \frac{{3n}}{2}{O_2}\) \( \to nC{O_2} + \) \((n + 1){H_2}O\)
3.3.1 Oxydation ménagée.
a) Oxydation catalytique à l’air.
Chauffons légèrement un bécher contenant un alcool, nous obtenons un mélange de vapeur d’alcool et d’air. Lorsqu’on introduit dans le bécher un fil de cuivre ou de platine préalablement chauffé, l’incandescence demeure. Il se produit dont une oxydation de l’alcool qui dégage de la chaleur. Les gaz résultant de cette oxydation sont soumis à plusieurs test donc les résultats sont les suivants :
Si l’alcool initial utilisé est un alcool primaire, le test à la 2,4-DNPH est positif, le test au réactif de Schiff est également positif et en fin un papier indicateur de pH humide vire au rouge.
Les deux premiers tests nous montre la présence d’un aldéhyde et le troisième celle d’un acide carboxylique.
Les équations des réactions qui ont lieu sont :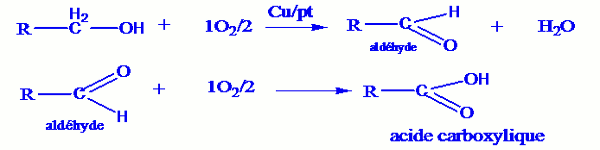
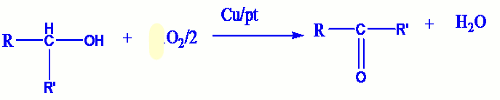 - Si l’alcool initialement utilisé est tertiaire, aucun test n’est positif. On conclut alors que l’oxydation ménagée des alcools tertiaires est impossible.
- Si l’alcool initialement utilisé est tertiaire, aucun test n’est positif. On conclut alors que l’oxydation ménagée des alcools tertiaires est impossible.
b) Oxydation ménagée par déshydrogénation catalytique.
En faisant passer des vapeurs d’alcools sur du cuivre chauffé à 250°C, on obtient :
- Pour un alcool primaire uniquement un aldéhyde.
- Pour un alcool secondaire une cétone.
- Un alcool tertiaire rien.
Les équations bilans des deux premières réactions sont :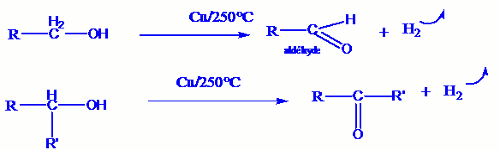 Par contre si nous faisons passer des vapeurs d’alcools sur du platine chauffé à 250°C nous obtenons :
Par contre si nous faisons passer des vapeurs d’alcools sur du platine chauffé à 250°C nous obtenons :
- Un aldéhyde puis un acide carboxylique dans le cas d’un alcool primaire.
- Une cétone dans le cas d’un alcool secondaire.
- On n’obtient rien dans le cas d’un alcool tertiaire.
C) oxydation en solution aqueuse.
Généralement, cette oxydation ménagée s’effectue à l’aide des solutions aqueuse oxydantes tel que KMnO4 et K2Cr2O7.
Expérimentalement, deux cas sont à préciser :
* Si l’oxydant est en défaut :
- L’alcool primaire s’oxyde en aldéhyde.
- L’alcool secondaire s’oxyde en cétone.
- L’alcool tertiaire ne s’oxyde pas.
* Si l’oxydant est en excès :
- L’alcool primaire est oxydé totalement en acide carboxylique
- L’alcool secondaire en cétone
- L’alcool tertiaire ne s’oxyde pas.
L’oxydation permet de distinguer sans ambigüité les trois classes d’alcools.
3.3.2 La réaction d’estérification.
Une réaction d’estérification est une réaction entre un alcool et un acide carboxylique.
Elle produit un ester et une molécule d’eau.
- Caractéristiques.
C’est une réaction lente, réversible, athermique et limité.
L’équation bilant d’une telle réaction dans le cas général s’écrit :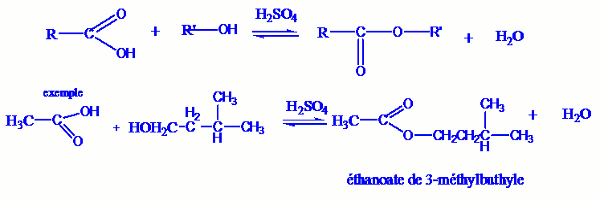 Remarque :
Remarque :
- La réaction inverse de l’estérification est appelé l’hydrolyse des esters.
- La quantité d’ester formé ne dépend que des proportions initiales des réactifs et de la classe de l’alcool.
- L’élévation de température ou la présence d’un catalyseur influence sur la vitesse de la réaction sans changer sa limite.
- La réaction de saponification est une réaction entre un ester et une base. On obtient un ion carboxylate R-COO- et l’alcool de départ.
La réaction générale de saponification est :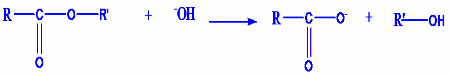 4. Préparation des alcools.
4. Préparation des alcools.
La préparation des alcools se fait par hydratation des alcènes ou par fermentation des glucides.
4.1 Hydratation des alcènes.
En présence d’acide sulfurique H2SO4 à 250°C ou d’acide phosphorique, les alcènes s’hydratent en alcools.
- Si la molécule d’alcène est symétrique, on obtient un seul produit.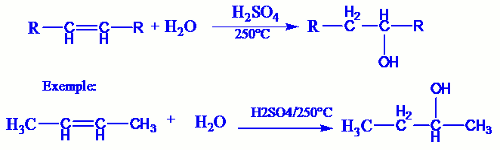 - Si la molécule d’alcène est dissymétrique, on obtient deux produits dont le plus prépondérant est celui qui respecte la règle de Markovnikov :« lors de l’addition d’une molécule d’eau sur un alcène dissymétrique, l’atome d’hydrogène de la molécule d’eau se fixe préférentiellement sur le carbone le plus hydrogéné de la double liaison »
- Si la molécule d’alcène est dissymétrique, on obtient deux produits dont le plus prépondérant est celui qui respecte la règle de Markovnikov :« lors de l’addition d’une molécule d’eau sur un alcène dissymétrique, l’atome d’hydrogène de la molécule d’eau se fixe préférentiellement sur le carbone le plus hydrogéné de la double liaison »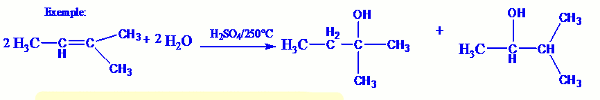 4.2 Fermentation des glucides : cas de l’éthanol.
4.2 Fermentation des glucides : cas de l’éthanol.
L’éthanol peut être obtenu par fermentation des glucides tels que le glucose ou le fructose isomère du glucose de formule C6H12O6, le bilan de cette fermentation est :
\({C_6}{H_{12}}{O_6}\) \( \to 2{C_2}{H_6}O\) \( + 2C{O_2}\)
C’est une réaction enzymatique qui se déroule en l’absence de l’oxygène sous l’action d’enzymes contenues dans les microorganismes.
Remarque :
Tous les sucre ne sont pas fermentescible, c’est le cas du saccharose issu de la canne à sucre de formule C12H22O11 qu’il faut d’abord hydrolyser en glucose simple tel que :
\({C_{12}}{H_{22}}{O_{11}} + {H_2}O\) \( \to 2{C_2}{H_{12}}{O_6}\)
5. Quelques polyalcools.
Encore appelés polyols, les polyalcools sont des composés organiques comportant plusieurs groupements hydroxyles fixés à des atomes tétragonaux différents.


