Exercice 1
1. Répondre par vrai ou faux..
1.1 Une réduction est un gain d’électrons.
1.2 Une espèce chimique capable de céder des électrons est un réducteur.
1.3 Les ions cuivre (II) ( Cu2+ ) et le métal fer (Fe) constitue un couple oxydant/réducteur.
1.4 Dans une réaction d’oxydoréduction, l’espèce chimique oxydante est réduite.
2.1 Quels sont les couples redox présents dans l’extrait de la classification électrochimique ci-dessous ?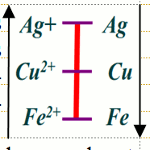 2.2 Parmi ces couples, quel est l’oxydant le plus fort ? le réducteur le plus fort ?
2.2 Parmi ces couples, quel est l’oxydant le plus fort ? le réducteur le plus fort ?
2.3 A l’aide de quel(s) réducteur(s) peut-on réduire l’ion Cu2+ ? l’ion Ag+ ?
3. Soient les équations d’oxydoréduction spontanées suivantes :
\(a){\rm{ }}A{u^{3 + }} + Hg\) \( \to Au + H{g^{2 + }}\)
\(b){\rm{ }}A{u^{3 + }} + Ag\) \( \to Au + A{g^ + }\)
\(c){\rm{ }}H{g^{2 + }} + Ag\) \( \to Hg + A{g^ + }\)
\(d){\rm{ }}A{g^ + } + Cu\) \( \to Ag + C{u^{2 + }}\)
3.1 Équilibrer ces équations.
3.2 Établir la classification électronique des couples qui y interviennent.
4. À partir de l’échelle des pouvoirs réducteurs comparés des métaux, prévoir si les réactions suivantes sont envisageables.
4.1 Action des ions Cu2+ sur Ag
4.2 Action des ions Ag+ sur Cu
4.3 Action des ions Zn2+ sur Fe
4.4 Action des ions Mg sur Fe2+
Exercice 2
1. Soient les tests suivants :
\(E + {F^ + } \to {E^ + } + F\)
\(B + {E^ + } \to {B^ + } + E\)
\(C + {D^ + } \to {C^ + } + D\)
\(B + {A^ + } \to \) Pas de réaction
\(C + {B^ + } \to \) Pas de réaction
\(E + {D^ + } \to \) Pas de réaction
Classer les métaux hypothétiques (A, B,C, D, E, et F) par ordre croissant du pouvoir réducteur.
2. On réalise les expériences suivantes :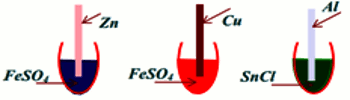 2.1 Quels sont les couples oxydants/réducteurs intervenant dans les trois expériences ?
2.1 Quels sont les couples oxydants/réducteurs intervenant dans les trois expériences ?
2.2 En utilisant la classification électrochimique des métaux, indiquer s’il y a ou non un dépôt métallique sur la lame de métal ?
2.3 Écrire l’équation bilan de la réaction chimique traduisant le dépôt métallique.
3. On donne l'équation suivante :
\({S_2}O_8^{2 - } + Hg_2^{2 + }\) \( \to 2SO_4^{2 - } + 2H{g^{2 + }}\)
3.1 Identifier les deux couples redox mis en jeu dans cette réaction.
3.2 Écrire les demi-équations d'oxydoréduction correspondant à ces couples.
3.3 Déterminer quels sont, respectivement, l'oxydant et le réducteur fort dans la transformation étudiée
\({E^0}(H{g^{2 + }}/Hg_2^{2 + }) = 0,91{\rm{V}}\)
Exercice 3
1. Soient quatre demi-piles A, B, C et D dans des solutions d’ions respectifs A2+ , B2+ , C2+ et D2+
Les résultats suivants sont trouvés lorsque les demi-piles sont connectées :
| Cathode | Anode | U |
| C | A | 0,75 V |
| D | A | 0,49V |
| D | B | 0.61V |
Classer les métaux de l'oxydant le plus fort au plus faible.
2. Soit la pile suivante : un morceau de nickel est immergé dans un bécher contenant une solution de chlorure de nickel, et un morceau de cuivre est immergé dans un bécher contenant une solution de sulfate de cuivre. Les électrodes de métal sont reliées par un fil électrique et les béchers sont connectés par un pont salin. L'équation de la réaction est : \(Ni + C{u^{2 + }}\) \( \to N{i^{2 + }} + Cu\)
2.1 Fais un dessin
2.2 Quelle électrode est l'anode ?
2.3 Vers quelle électrode les ions \(SO_4^{2 - }\) progressent-ils ?
2.4 Vers quelle électrode les électrons se déplacent-ils ?
2.5 Si 0,025 mol de Cu sont produites, combien de moles d'électrons circulent à travers le fil ?
Exercice 4
1. L’étain est attaqué par l’acide sulfurique dilué avec formation de dihydrogène et d’ion étain (II).
Par ailleurs, lorsque l’on trempe un fil d’aluminium bien décapé dans une solution de dichlorure d’étain ( SnCl2), le fil se recouvre de cristaux d’étain.
En déduire les positions relatives des couples redox mis en jeu dans ces deux réactions.
2. On fait agir de l’acide chlorhydrique sur un morceau de laiton, alliage de zinc et de cuivre
2.1 Identifier le métal qui agit avec H+
2.2 Ecrire l’équation bilan de la réaction.
2.3 Déterminer la relation entre les quantités de matière des éléments mis en jeu.
2.4 Calculer les quantités de matières de réactifs sachant que nous avons dans l’alliage 1 g de zinc dans 50 ml d’acide chlorhydrique de concentration C=1 mol/l.
2.5 Déterminer le réactif en défaut
2.6 Calculer les quantités de matière des produits et le volume du dihydrogène dégagée dans les condition ou Vm=24,4 L
Exercice 5
On constitue une pile à partir de l’E.S.H. et une électrode de zinc trempant dans une solution de sulfate de zinc. Sachant que le zinc est plus réducteur que le dihydrogène :
1. Polariser cette pile.
2. Quels sont les ions en solution? Indiquer le sens de déplacement de toutes les entités chargées quand la pile débite.
3. Écrire l’équation bilan de la réaction globale.
4. Quel est le signe du potentiel de l’électrode de zinc ?
5. Calculer la variation de de masse m de l’électrode de zinc.
6. Quel est le volume du gaz dégagé ?
Données : La pile fonctionne pendant 6 heures et débite une intensité électrique de 20 mA. Vm=24 mol/L
Exercice 6
1. On réalise une pile avec les couples Au3+ /Au et Mg2+ /Mg,
1.1. Faire le schéma de cette pile
1.2. Écrire l’équation de fonctionnement de cette pile.
1.3. Calculer sa f.é.m. pour la concentration de la solution égale à 1 mol/L
2. On considère les piles P1 et P2 décrites comme suit :
P1 - \(Mg/M{g^{2 + }}||C{u^{2 + }}/Cu\) +
P2 - \(C{u^{2 + }}/Cu||P{t^{2 + }}/Pt\) +
\(E_2^0 = 0,76{\rm{V}}\)
2.1. Déterminer les potentiels standards des couples Mg2+ /Mg et Pt2+ /Pt
2.2. Réaliser une pile P3 à partir des couples Mg2+ /Mg et Pt2+ / Pt
2.3. Faire le schéma annoté de la pile P3, Donner le sens du courant lorsque la pile débite
Exercice 7
On plonge une masse m=5 g d'un bronze ( alliage de cuivre et d'étain ) contenant en masse 23% d'étain dans V=200 mL d'acide chlorhydrique telle que la concentration en ion hydronium soit C=1 mol/L.
1. Un réaction naturelle peut elle se produire? Si oui, écrire l'équation bilan
2. Quelles sont les quantité de matière initiale de chaque réactif?
- En déduire qui est en excès et de combien?
3. Quels sont les concentrations finales des ions?
4. Vérifier que la solution est électriquement neutre.
5. Quelle est la quantité d'électricité mise en jeu ? MSn=118,7;
Exercice 8
L’eau oxygénée de formule H2O2 participe à deux couples redox :
- Le couple (H2O2/H2O) de potentiel
redox standard E1° = 1,77 V
- Le couple (O2/H2O2) de potentiel rédox standard E2° = 0,68 V 1
1. Écrire la demi-équation rédox correspondant au couple,
Quel est l’oxydant de ce couple 1?
2. Écrire la demi-équation rédox correspondant au couple 2,
Quel est le réducteur de ce couple ?
3. Quelle est la réaction redox spontanée entre ces deux couples ?
4. Quel rôle y joue l’eau oxygénée ?
Une eau oxygénée est dite « à 10 volumes » si un litre de cette solution est susceptible de libérer 10 litres de gaz O2 par la réaction du 3 (volume mesuré dans les conditions normales de température et de pression : température 0°C, pression 1 atm, volume molaire normal = 22,4 L/mol ).
5. Quelle est la concentration C d’une solution d’eau oxygénée à 10 volumes ?



