Exercice I
1. Le composé étant aromatique, supposons que la molécule de benzène est monosubstituée , on a : \({C_6}{H_5} - {C_x}{H_y}\) soit \({C_8}{H_{10}}\) soit \({C_6}{H_5} - {C_2}{H_5}\)
Par identification, x=2 et y=5
C’est l’éthylbenzène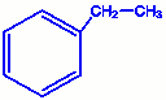 Supposons à présent cette molécule disubstituée : \({C_6}{H_4} - {C_x}{H_y}\) qui vaut \({C_8}{H_{10}}\) soit \({C_6}{H_4} - {C_2}{H_6}\) soit \({C_6}{H_4} - {(C{H_3})_2}\)
Supposons à présent cette molécule disubstituée : \({C_6}{H_4} - {C_x}{H_y}\) qui vaut \({C_8}{H_{10}}\) soit \({C_6}{H_4} - {C_2}{H_6}\) soit \({C_6}{H_4} - {(C{H_3})_2}\)
Par identification, x=2 et y=6
C’est la formule brute du styrène . Elle est de formule semi-développée
C’est le 1,2 dimé-thylbenzène ou l’orthostyrène
C’est le 1,3 diméthylbenzène ou le méta styrène
C’est le 1,4 diméthylbenzène ou le parastyrène
Si la molécule est trisubstituée, nous avons C6H3-C2H7 ce qui n’est pas possible puisque la tétravalence de l’ un des atomes de carbone dans le substituant C2H7 n’est pas respectée.
2. Écrivons les formules semi-développées des hydrocarbures 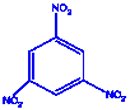 a) 1, 3, 5-trinitrobenzène
a) 1, 3, 5-trinitrobenzène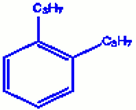 b) orthodipropylbenzène
b) orthodipropylbenzène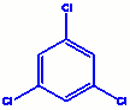 c) 1, 3, 5-trichlorobenzène
c) 1, 3, 5-trichlorobenzène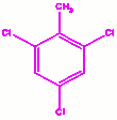 d) 2, 4, 6-trichlorotoluène
d) 2, 4, 6-trichlorotoluène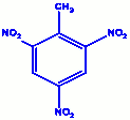 e) 2, 4, 6-trinitrotoluène
e) 2, 4, 6-trinitrotoluène f) Paraxylène
f) Paraxylène
3.1Le chlorure de fer (III), ou chlorure ferrique ou perchlorure de fer est un acide de Lewis, il est utilisé comme catalyseur dans la chloration du benzène.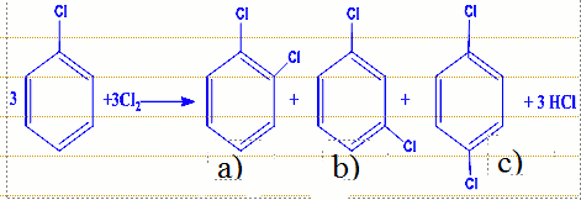 a) 1,2-dichlorobenzène ou orthodichlorobenzène
a) 1,2-dichlorobenzène ou orthodichlorobenzène
b)1,3-dichlorobenzène ou métadichlorobenzène
c)1,4- dichlorobenzene ou paradichlorobenzène.
3.2. En présence de la lumière utilisé comme catalyseur, la chloruration du benzène produit une fumée blanche : c’est du 1,2,3,4,5,6-hexachlorocyclohexane suivant l’équation :
\({C_6}{H_6} + 3C{{\rm{l}}_2}\) \(\xrightarrow{lumière}\) \({C_6}{H_6}C{l_6}\)
4. Un dérivé bromé du benzène contient en masse 50,96 % de brome.
4.1) Déterminons la formule du dérivé en question.
La formule de ce composé est la suivante C6HxBr6-x
\(\% Br = \frac{{(6 - x){M_{Br}}}}{M}.100\), \(\% C = \frac{{72}}{M}.100\), \(\% H = \frac{x}{M}.100\),
\(\% C + \% H\) \( = \frac{{72}}{M}.100 + \frac{x}{M}.100\) \( = 100 - 50,96\)
Le composé est monosubstitué de formule brute C6H5Br.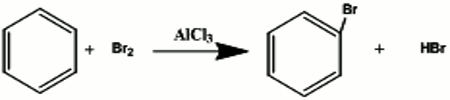 5.1 Formule brute du composé
5.1 Formule brute du composé
\(\% C = \frac{{12x}}{M}.100\) \( \Rightarrow x = \frac{{\% C \times M}}{{1200}} = 6\)
\(\% C = \frac{y}{M}.100\) \( \Rightarrow y = \frac{{\% H \times M}}{{100}} = 6\)
Ce composé est de formule C6H6
5.2.1 Ce composé est le benzène de formule développée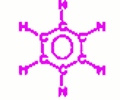 5.2.2 Équation de réaction :
5.2.2 Équation de réaction :
\({C_6}{H_6} + 3{H_2}\) \(\xrightarrow{{250^o}C,40 bars, Nickel divisée }\) \({C_6}{H_{12}}\)
C’est une réaction d’addition
5.2.3 Calcule du volume de dihydrogène utilisé. D’après l’équation de réaction :
\(\frac{{{n_{{C_6}{H_6}}}}}{1} = \frac{{{n_{{H_2}}}}}{3}\) \( \Leftrightarrow \) \(\frac{{{m_{{C_6}{H_6}}}}}{{{M_{{C_6}{H_6}}}}} = \frac{{{V_{{H_2}}}}}{{3{V_0}}}\), \({V_{{H_2}}} = \frac{{{m_{{C_6}{H_6}}}}}{{{M_{{C_6}{H_6}}}}} \times 3{V_0}\), \({V_{{H_2}}} = 16,8L\)
6. Équations de réaction et formules brutes.
a) \({C_6}{H_6} + 3{H_2} \to {C_6}{H_{12}}\)
Le produit est le cyclohexane.
b) \({C_7}{H_8} + 3{H_2} \to {C_7}{H_{14}}\)
Le produit est le méthylcyclohexane.
c) \({C_6}{H_6} + C{l_2} \to \) \({C_6}{H_5}Cl + HCl\)
Le produit est le monochlorobenzène et l’ acide chloridrique (HCl).
d) \({C_6}{H_5}Cl + C{l_2}\) \( \to {C_6}{H_4}C{l_2} + HCl\)
Le produit est le dichlorobenzène et l’acide chloridrique (HCl).
Exercice II
A. Nombre de mole de monochlorobenzène obtenu
De l’expression du rendement, nous avons :
\(r = \frac{{{n_{b(reagi)}}}}{{{n_{b(initial)}}}}100\) \( = \frac{{{m_{b(reagit}}}}{{{M_b}}} \times \frac{{{M_b}}}{{{m_{_{b(initial)}}}}}100\) \( = \frac{{{m_{b(reagit}}}}{{{m_{_{b(initial)}}}}}100\)
\({m_{b(reagi)}} = \frac{r}{{100}}{m_{_{b(initial)}}}\) soit \({m_{b(reagit)}} = 2,4g\)
De l’équation de réaction :
\({C_6}{H_6} + C{l_2}\) \(\xrightarrow{AlCl3}\) \({C_6}{H_5}Cl + HCl\)
\({n_{{C_6}{H_6}}} = {n_{{C_6}{H_6}Cl}}\) \( = \frac{{{m_{b(reagi)}}}}{{{M_{{C_6}{H_6}}}}} = \frac{{2,4}}{{78}}\) \( = 0,031mol\)
B. Le mélange de dihydrogène et de 0,50 g de benzène passe sur du nickel chauffé à 200°C conduit au cyclohexane suivant l’équation :
\({C_6}{H_6} + 3{H_2}\) \(\xrightarrow{{250^o}C,40 bars, Ni }\) \({C_6}{H_{12}}\)
Calcule de la masse du cyclohexane de l’équation de réaction
\(\frac{{{m_B}}}{{{M_B}}} = \frac{{{m_{cyclohexane}}}}{{{M_{cyclohexane}}}}\) \( \Rightarrow {m_{cyclohexane}}\) \( = \frac{{{m_B}}}{{{M_B}}}{M_{cyclohexane}}\)
\({m_{cyclohexane}} = 0,577g\)
La combustion du cyclohexane est donnée par l’équation :
\({C_6}{H_{12}} + 9{O_2}\) \( \to 6C{O_2} + 6{H_2}O\)
Calcule de la masse de cyclohexane ayant réagi :
\(\frac{{{m_{{H_2}O}}}}{{6{M_{{H_2}O}}}} = \frac{{m{'_{cyclohexane}}}}{{{M_{cyclohexane}}}}\), \(m{'_{cyclohexane}} = \frac{{{m_{H2O}}}}{{6{M_{H2O}}}}{M_{cyclohexane}}\), \(m{'_{cyclohexane}} = 0,45g\)
Calcule du rendement : \(r = \frac{{n{'_{cyclohezane}}}}{{{n_{cyclohezane}}}} \times 100\) \( = \frac{{m{'_{cyclohezane}}}}{{{m_{cyclohezane}}}} \times \frac{{{M_{_{cyclohezane}}}}}{{{M_{cyclohezane}}_{}}}100\) \( = \frac{{m{'_{cyclohezane}}}}{{{m_{cyclohezane}}}}100\) \( = \frac{{0,45}}{{0,577}}100 = 80\% \)
Exercice III
1. Déterminons la formule brute de B. Relation entre la masse de carbone et celle d’hydrogène \(\left. \begin{array}{c}{m_C} \to {m_H}\\6 \to 1\end{array} \right\} \Rightarrow {m_C} = 6{m_H}\)
Ainsi : \(\% C = \frac{{{m_C}}}{{{m_B}}}100\), \(\% C = \frac{{6{m_H}}}{{{m_B}}}100{\rm{ }}\), \(\% H = \frac{{{m_H}}}{{{m_B}}}100\)
\(\frac{{\% C}}{{\% H}} = 6 \Rightarrow \% C = 6\% H\), \(\% H = \frac{{100}}{7} = 14,30\), \(\% C = 100 - 14,30 = 85,70\)
Supposons cet hydrocarbure de formule CxHy, ainsi : \(\% C = \frac{{1200x}}{{{M_B}}} \Rightarrow x = 8\), \(\% H = \frac{{100y}}{{{M_B}}} \Rightarrow y = 16\)
2. Le composé B est de formule C8H16.
B est obtenu par hydrogénation
\({C_8}{H_{10}} + 3{H_2} \to {C_8}{H_{16}}\)
NB : Le composé B, bien étant saturé ne respecte pas la formule générale de alcane CnH2n+2, il est de formule CnH2n, c’est un alcane cyclique.
3. Formules développées possibles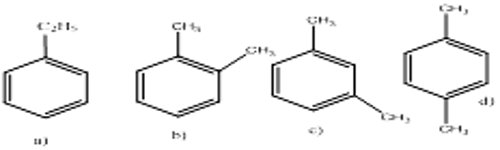 4. a) Équation de réaction
4. a) Équation de réaction
\({C_8}{H_{10}} + xC{l_2}\) \( \to {C_8}{H_{10 - x}}C{l_x}\) \( + xHCl\)
\(\% Cl = \frac{{35,5x}}{{{M_C}}}100{\rm{ ; }}\) \({\rm{ }}\% C + \% H = \frac{{106 + x}}{{{M_C}}}100\)
Après combinaison des deux équations vous obtenez x=1, C vaut C8H9Cl
4.b) L’équation de réaction devient
\({C_8}{H_{10}} + C{l_2}\) \( \to {C_8}{H_9}Cl + HCl\)
5.a Conditions expérimentales : l’alkylation du benzène est catalysé par un acide de Lewis (AlCl3, FeCl3 ..) et en absence de lumière.
Équation de réaction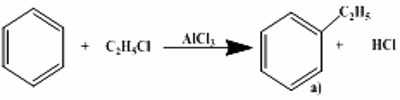 5.b) Le produit obtenu a) est l’éthylbenzène.
5.b) Le produit obtenu a) est l’éthylbenzène.
Exercice IV
1. Formules brutes des hydrocarbures de formule générale C7Hy
\(\frac{M}{{100}} = \frac{y}{{\% H}}\) \( \Rightarrow y = \frac{{84}}{{\frac{{100}}{{\% H}} - 1}}\)
Pour 8,69%, y=8 et la formule brute de la molécule est : C7H8.
Pour 14,28%, y=14 et la formule brute de la molécule est : C7H14.
Pour 16%, y=16 et la formule brute de la molécule est : C7H16.
Les seules formules brutes liées par une hydrogénation catalytique sont données par cette équation
\({C_7}{H_8} + 3{H_2}\) \(\xrightarrow{{250^o}C,40 bars, Ni }\) \({C_7}{H_{14}}\)
Le composé C7H14 obéit à l’équation générale CnH2n, c’est est un alcane cyclique ou un alcène. Si c’est un alcène, il peut donner une réaction d’ addition, alors, c’est un alcane cyclique
2.a Le composé C vaut (C7H16 ) et est un alcane:
2.b De l’équation précédente, B vaut ( C7H8 ), C’est le méthylbenzène
Le composé A vaut (C7H14) est un alcane cyclique, C’est méthylcyclhexane
\(B + C{H_3}Br\) \(\xrightarrow{FeBr3 }\) \(D + HBr\)
C’est le 1,2 dimé-thylbenzène ou l’orthostyrène
C’est le 1,3 diméthylbenzène ou le méta styrène
C’est le 1,4 diméthylbenzène ou le parastyrène
3.b) D’après la représentation spatiale du parastyrène, sa monochloration ne donnera qu’un seul isomère, le composé D est le parastyrène.
Équation de réaction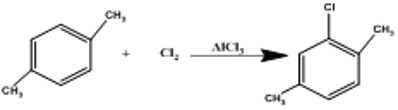
Exercice V
5.a) Équation de réaction
\({C_7}{H_8} + HN{O_3}\) \(\xrightarrow{H2SO4}\) \({C_7}{H_7}N{O_2} + {H_2}O\)
Formule développée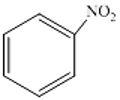 La réaction à lieu en présence de H2SO4.
La réaction à lieu en présence de H2SO4.
5.b) Calcule de la quantité de matière du nitrotoluène
\({C_7}{H_8}\left\{ \begin{array}{l}{m_1} = 100 \times {10^3}g\\{M_1} = 92g/mol\end{array} \right.\) r = 90%
Le C7H8 et C7H7NO2 réagissent mole à mole, soit : \({m_2} = \frac{{100 \times {{10}^3}}}{{92}}137\) \( = 149 \times {10^3}g\)
m2 est ici la masse théorique du nitrotoluène, la masse réelle m’2 est obtenue en tenant compte du rendement de la réaction. \(m{'_2} = \frac{{90}}{{100}}.149 \times {10^3}\) \( = 134 \times {10^3}g\)
5.c) Calcule du volume de para nitrotoluène
Soit mm la masse de métatoluène
mO la masse de l’orthotoluène
mP la masse de paratoluène restante
\({m_m} = \frac{2}{{100}}m{'_2}\) \( = \frac{2}{{100}}134 \times {10^3}\) \( = 2682g\)
\({m_O} = \frac{{0,5}}{{100}}m{'_2}\) \( = \frac{{0,5}}{{100}}134 \times {10^3} = 670g\)
\({m_P} = \) \(m{'_2} - {m_m} - {m_O}\) \( = 130648g\)
Calcule du volume du paranitrotoluène obtenu.
\(\rho = \frac{{{m_P}}}{{{V_P}}} \Rightarrow \) \({V_P} = \frac{{{m_P}}}{\rho } = \frac{{130648}}{{1100}}\) \( = 118,78l\)


