Situation problème :
Un jeune élève de terminale C, après son premier cours sur le noyau atomique veut s’avoir pourquoi les nucléons restent toujours dans le noyau alors qu’en seconde, on lui a dit pendant le cours de physique que deux corps de même nature se repoussaient.
Aide-le à répondre à cette question.
Objectif :
• Connaître la structure du noyau atomique ainsi que ses constituants
• Définir et déterminer l’énergie de liaison par nucléon
• Conclure sur la stabilité du noyau.
I. Quelques définitions
L’atome est l’élément constitutif de la matière, indivisible et homogène.
Un atome est constitué d'un noyau encore appelé nucléide constitué d'électrons et de nucléons (protons et neutrons).
Le noyau d’un atome est noté \({}_Z^AX\) où \(X\) est le symbole de l'atome, \(A\) le nombre de masse et \(Z\) le nombre de charge ou numéro atomique.
Avec \(A = N + Z\)
En physique nucléaire, on utilise l'unité de masse atomique :
\(1u = \) \(1,66054 \times {10^{ - 27}}kg\) et \(1u = 931,5MeV.{C^{ - 2}}\)
Les isotopes d'un élément sont les atomes de cet élément ayant même nombre de charge \(Z\) mais de nombre de masse \(A\) différent.
Les isobares sont des nucléides possédant le même nombre de masse (même valeur de A) ou de nucléons. Ces nucléides possèdent par conséquent des nombres de neutrons et de protons différents (valeurs de N et de Z différentes).
Les isotones sont des nucléides possédant le même nombre de neutrons (même valeur de N), mais un nombre de protons différent (valeur de Z et donc de A différentes).
II. La stabilité d’un noyau atomique
Un atome est stable lorsque le nombre de neutrons dans son noyau est à peu près egqle au nombre de protons, en effet, les éléments légers sont stables pour \(N \sim Z\) et les éléments plus lourds pour \(N \sim 1,5 \times Z\)
La stabilité nucléaire correspond à la stabilité du noyau d'un atome.
Elle dépend de la force de répulsion des protons et de la force nucléaire. Un atome dont le noyau est trop instable a tendance à se désintégrer de sorte d’en générer un ou plusieurs noyaux plus stables.
Soit \(M (A, Z)\) la masse d’un noyau possédant A nucléons dont Z protons (et N neutrons), notons m p la masse du proton et m n celle du neutron ; l’expérience révèle que pour l’ensemble des noyaux présents dans notre environnement :
\(M\left( {A,Z} \right) \prec \) \(Z{m_p} + N{m_m}\)
La différence \(\Delta m = |M\left( {A,Z} \right) - \) \(\left( {Z{m_p} + N{m_m}} \right)|\) est appelée le défaut de masse.
Einstein a pu montrer qu’à cette différence de masse était attribuée une énergie dite énergie de liaison, en effet : \(E = \Delta m{C^2}\)
L’énergie de liaison, notée \({E_l}\), est l’énergie qu’il faut fournir à un noyau au repos pour le dissocier en nucléons isolés et immobiles.
\({E_l} = |M\left( {A,Z} \right) - \) \(\left( {Z{m_p} + N{m_m}} \right)|{C^2}\)
Le défaut de masse est à l’origine de la stabilité des noyaux usuels.
L’énergie de liaison par nucléon, notée \(\frac{{{E_l}}}{A}\) est l’énergie moyenne de liaison \({{E_l}}\) par nucléon.
L’énergie de liaison ou de cohésion \({{E_l}}\) d’un noyau est pratiquement proportionnelle au nombre total \(A\) des nucléons constitutifs.
Alors, \(\frac{{{E_l}}}{A}\) peut se calculer comme étant le quotient de l’énergie de liaison \({{E_l}}\) par le nombre de masse A.
\({E_{l/A}} = \frac{{{E_l}}}{A}\)
L’énergie de liaison par nucléon est donc influencée par le nombre de masse d’un noyau et est illustrée par la courbe de la figure ci-dessous connue sous le nom de courbe d’Aston.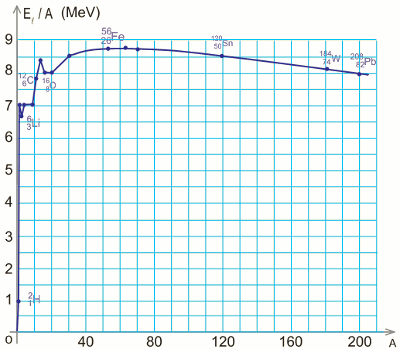 La courbe d'Aston est caractérisée par :
La courbe d'Aston est caractérisée par :
• un niveau zéro de l’énergie correspondant aux nucléons séparés et au repos.
• un minimum d’énergie (\(30 \prec A \prec 80\)) correspondant aux noyaux dont les nucléons sont les plus liés, donc les plus stables.
Ainsi, la courbe d’Aston permet d’illustrer la stabilité relative des noyaux. Les noyaux légers (\(A \prec 20\)) et les noyaux lourds (\(A \succ 190\)) sont instables car ils ont une faible énergie de liaison par nucléon tandis que les noyaux de nombre de masse moyen (voisin de 60) sont stables parce qu’ils ont l’énergie de liaison par nucléon la plus élevée.
Un noyau est d’autant plus stable que son énergie de liaison par nucléon est plus grande.
Les noyaux naturels les plus stables sont ceux de nombre de masse voisin de 60 :
\(7,8MeV \prec {E_{l/A}}\) \( \prec 8,8MeV\)
III. Quelques unités utilisées en physique nucléaire
En physique et en chimie, l'électronvolt ou électron-volt (au pluriel électronvolts ou électrons-volts) de symbole (eV) est une unité de mesure d'énergie.
\(1eV = {1,610^{ - 19}}J\)
MeV \( \equiv \) Méga électronvolt
\(1MeV = {10^6}eV\)
\(1MeV = 1,6 \times {10^{ - 13}}J\)
La vitesse de la lumière dans le vide notée \(C\) est donnée par
\(C = 3 \times {10^{ - 19}}m/s\)


