Exercice I : Chimie organique
1. Formule développées des composés : 0,5x2=1 pt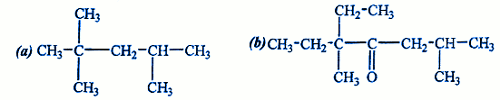 2. Noms des composees : 0,5 x2 = 1 pt
2. Noms des composees : 0,5 x2 = 1 pt
a) 3-éthylpent-1-yne
b) 3-éthylhex-2-ène
3.1 Un catalyseur : acide sulfurique 0,5 pt
3.2 Equation bilan de la réaction 1 pt
\(C{H_3} - CH = C{H_2}\) \( + {H_2}O\) \(\xrightarrow{{H_2}S{O_4}}\) \(\begin{array}{*{20}{c}}{C{H_3}}&{ - CH - }&{C{H_3}}\\{}&|&{}\\{}&{OH}&{}\end{array}\)
3.3 le propan-2-ol est majoritaire car il respecte la règle de Markovnikov.( l’hydrogène s’est fixé sur le carbone le plus hydrogéné 0,5 pt
3.4 Formule semi-développée de l’alcool majoritaire 0,5 pt
\(C{H_3} - C{H_2} - \) \(C{H_2} - OH\)
3.5 Masse de propan-2-ol obtenue 0,5 pt
D’après l’équation-bilan :
\({n_{{C_3}{H_8}O}} = \) \({n_{{C_3}{H_6}}} \Rightarrow \) \({m_{{C_3}{H_8}O}} = \) \(\frac{{{m_{{C_3}{H_8}O}} \times {V_{{C_3}{H_6}}}}}{{Vm}}\)
Application numérique 0,5 pt
\({m_{{C_3}{H_8}O}} = 15g\)
4.1 Equation-bilan 1 pt
\({C_6}{H_6} + C{l_2}\) \(\xrightarrow{FeC{l_3}}\) \({C_6}{H_5} - \) \(Cl + HCl\)
4.2 La réaction doit avoir lieu dans l’obscurité 0,5 pt
5. Définition :
a) Reformage catalytique : Opération chimique qui consiste à modifier la structure d’un hydrocarbure sans changer son nombre d’atomes de carbone en présence d’un catalyseur 0,5 pt
b) Indice d’octane : Grandeur qui caractérise la résistance d’un carburant à l’auto-inflammation 0,5 pt
Exercice II Oxydoréduction et engrais /8points
Oxydoréduction / 5 pts
1.1 Définition : Un oxydant est une espèce chimique contenant un élément dont le nombre d’oxydation diminue au cours d’une réaction chimique 0,5 pt
1.2.1 Oxydant fort : \(C{r_2}O_7^{2 - }\) 0,25 pt
Réducteur fort \({I^ - }\) 0,25 pt
1.2.2 Demi équation électronique du couple \(C{r_2}O_7^{2 - }/C{r^{3 + }}\) en milieu acide 0,75 pt
\(C{r_2}O_7^{2 - } + \) \(14{H_3}{O^ + } + 6{e^ - }\) \(\leftrightarrows\) \(2C{r^{3 + }} + \) \(21{H_2}O\)
1.2.3 Demi équation électronique du couple \({I_2}/{I^ - }\) 0,5 pt
\({I_2} + 2{e^ - }\) \(\leftrightarrows\) \({I^ - }\)
1.2.4 Equation bilan de la réaction
\(C{r_2}O_7^{2 - } + \) \(14{H_3}{O^ + } + 6{I^ - }\) \( \to 2C{r^{3 + }} + \) \(3{I_2} + 21{H_2}O\)
1.2.5.1 Détermination se n 0,25 pt
D’après l’équation-bilan de la réaction
\(\frac{n}{6} = \frac{{{n_{C{r_2}O_7^{2 - }}}}}{1}\) \( \Rightarrow n = 6CV\)
Application numérique
\(n = 0,06\) nol 0,25pt
1.2.5.2 Calcule de la concentration C des ions \(C{r^{3 + }}\) dans la solution finale
D’après l’équation bilan
\(\frac{n}{6} = \frac{{{n_{C{r^{3 + }}}}}}{2}\) \( \Rightarrow {n_{C{r^{3 + }}}} = \frac{n}{2}\) soit \(C = \frac{n}{{2V}}\) 0,25 pt
\(C = 0,02\) mol
1.3.1 Le métal constituant l’électrode négatif est le Zinc, car à partir des valeurs des potentiels standards, on constate que le métal zinc est plus réducteur et subira une oxydation 0,25x2==0,5 pt
1.3.2 Force électromotrice de la piLe
\(E = {E^o}(A{g^ + }/Ag)\) \( + {E^o}(Z{n^{2 + }}/Zn)\) \( = 1,56V\) 0,75 pt
2. Engrais / 3 pts
2.1 Signification des nombres :
L’écriture 12-10-25 signifie que dans 100 kg de cet engrais, on a 12 kg d’azote, 10kg d’oxyde de phosphore et 25 kg d’oxyde de potassium 0,25 x3 = 0,75 pt
2.2.1 L’élément fertilisant de l’engrais B est l’azote. Il est indispensable à la croissance de la plante 0,25 + 0.5 = 0,75 pt
2.2.2 Formule X-Y-Z de l’engrais obtenu en mélangeant une mase mA de A et une masse mB de B.
Dans le mélange de masse mA +mB on a : Masse totale en azote :
\({m_N} = \) \(\frac{{12{m_A} + 22{m_B}}}{{{m_A} + {m_B}}}\)
Pour un mélange de 100 kg, on aura
\(X = \) \(\frac{{12{m_A} + 22{m_B}}}{{{m_A} + {m_B}}}\)
En effectuant le même raisonnement pour \({P_2}{O_5}\) et \({K_2}O\), on a : \(Y = \frac{{10{m_A} + 0{m_B}}}{{{m_A} + {m_B}}}\) et \(Z = \frac{{25{m_A} + 0{m_B}}}{{{m_A} + {m_B}}}\)
Application numérique
X=18, Y=4 et Z=10 (0,5x3=1,5 pt)
Exercice III : Type expérimental / 4 points
1. Nom des éléments de la verrerie : 0,25x3=0,5 pt
a) Erlenmeyer
b) Cristallisoir
2. Deux substances acides dans le mélange : Acide nitrique et acide sulfurique 0,25x3=0,5 pt
3. On doit utiliser l’eau glacée afin de refroidir le milieu réactionnel car la réaction est fortement exothermique 0,5 pt
4. On verse le benzène goutte à goutte pour éviter des projections dues aux acides présents dans le mélange 0,5 pt
5. Equation-bilan de la réaction : 1 pt
\({C_6}{H_6} + \) \(HN{O_3}\) \(\xrightarrow{{H_2}S{O_4}}\) \({C_6}{H_5}N{O_2}\) \( + {H_2}O\)
6.1 Masse (mth) de mononitrobenzène attendue
La réaction a lieu mole à mole. Alors : 0,25 pt
\({m_{th}} = \) \(\frac{{{M_{{C_6}{H_8}N{O_2}}} \times {m_{{C_6}{H_6}}}}}{{{m_{{C_6}{H_6}}}}}\)
Application numérique 0,25 pt
\({m_{th}} = 189,23\) g 0,25 pt
6.2 Rendement
Soit \(\eta \) ce rendement
\(\eta = \frac{{{m_{obtenue}}}}{{{m_{th}}}} = 0,9\) 0,25 pt
Application numérique
\(\eta = 90\% \) 0,25 pt


