Exercice I : Chimie organique
1.1 Formule semi-développée de l’éthyne : \(HC \equiv CH\) 0,25pt
1.2 L’éthyne appartient à la famille des alcynes 0,25pt
1.3 Équation-bilan de la réaction : 0,5 pt
\(Ca{C_2}\) \( + 2{H_2}O\) \( \to \) \({C_2}{H_2} + \) \(Ca{(OH)_2}\)
1.4 Calcule du volume d’éthyne
Le pourcentage d’impureté étant 25%, celui de pureté est donc P=75%
\(P = \) \(\frac{{{m_{Ca{C_2}}}(pur)}}{{{m_{Ca{C_2}}}}} \times 100\)
Avec \({{m_{Ca{C_2}}} = 14}\) kg
\({m_{Ca{C_2}}}(pur) = \) \(\frac{{P.{m_{Ca{C_2}}}}}{{100}}\)
D’après le bilan molaire
\({n_{{C_2}{H_2}}} = \) \({n_{Ca{C_2}}}(pur)\)
Soit
\({V_{{C_2}{H_2}}} = \) \(\frac{{Vm \times P \times {m_{Ca{C_2}}}}}{{{M_{Ca{C_2}}}}}\) 0,5pt
AN : \({V_{{C_2}{H_2}}} = \) \(3937,5\) L 0,25pt
2.1 Formules semi-développées des deux produits :
* Éthène : \({H_2}C = C{H_2}\) 0,5pt
* Éthane : \({H_3}C - C{H_3}\) 0,5 pt
2.2 Structure géométrique de l’éthène : L’éthène a structure géométrique plane 0,25pt
2.3 Famille des composes appartenant à chacun des produits
* Éthène : Alcène 0,25pt
* Éthane : Alcane 0,25pt
2.4 Equations bilans se produisant à partir de l’éthyne
\({C_2}{H_2}\) \( + {H_2}\) \(\xrightarrow{Ni}\) \({C_2}{H_4}\) 0,5pt
\({C_2}{H_4} + \) \({H_2}\) \(\xrightarrow{Ni}\) \({C_2}{H_6}\) 0,5pt
2.5 Calcule du volume de l’éthane
Véthane= Véthyne – Véthène = 0,1-0,05=0,05 m3
3.1 Trois produits issus de la distillation sous vide du pétrole : Huiles, lubrifiants, fiouls lourds, paraffines… 0,25x3=0,75 pt
3.2 Importance du reformage catalytique : Il permet d’améliorer l’indice d’octane des carburants 0,25 pt
3.3.1 Formule semi-développée du benzène 0,5pt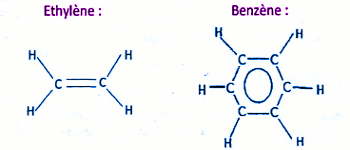 3.3.2 Trois précautions à prendre lors de la manipulation :
3.3.2 Trois précautions à prendre lors de la manipulation :
* Travailler sous une hotte aspirante
* Travailler dans une cuve contenant l’eau glacée
* Verser le benzène goutte à goutte
3.3.3 Calcule de la masse de l’acide nitrique fumant :
\({C_6}{H_6} + \) \(HN{O_3}\) \( \to \) \({C_6}{H_5}N{O_2}\) \( + {H_2}O\)
\({n_{{C_6}{H_6}}} = {n_{HN{O_3}}}\) (1)
\(P = \) \(\frac{{{m_{HN{O_3}}}}}{{{m_{HN{O_3}}}(fumant)}}\) \( \times 100\) (2)
De (1) et (2), nous obtenons :
\({m_{HN{O_3}}}(fumant)\) \( = \) \(\frac{{100 \times \varphi \times {V_m} \times {M_{HN{O_3}}}}}{{P \times {M_{{C_6}{H_6}}}}}\) 0,25 pt
AN : \({m_{HN{O_3}}}(fumant)\) \( = 789,77g\) 0,5 pt
3.3.4 Calcule de la masse du mono nitrobenzène obtenue
\(Rd = \) \(\frac{{{m_{{C_6}{H_5}N{O_2}}}(obtenue)}}{{{m_{{C_6}{H_5}N{O_2}}}(attendue)}}\) \( \times 100\)
Bilan molaire
\({m_{{C_6}{H_5}N{O_2}}}(attendue)\) \( = {n_{{C_6}{H_6}}}\)
Ainsi :
\({m_{{C_6}{H_5}N{O_2}}}(attendue)\) \( = \) \(\frac{{Rd \times {M_{{C_6}{H_5}N{O_2}}} \times \varphi \times V}}{{{M_{{C_6}{H_6}}} \times 100}}\) 0,25 pt
AN : \({m_{{C_6}{H_5}N{O_2}}}(attendue)\) \( = 1318,9\) g 0,25pt
Exercice II : Oxydoréduction et engrais 8 pts
I Oxydoréduction
I.1 Définitions :
* Dosage : Opération qui consiste à déterminer la concentration d’une espèce chimique dans une solution 0,25 pt
* Potentiel d’oxydoréduction : C’est la différence de potentiel en circuit ouvert entre électrode constituée d’un couple redox et l’électrode standard à hydrogène 0,25 pt
1.2 Équilibrage de l’équation-bilan en utilisant les nombres d’oxydation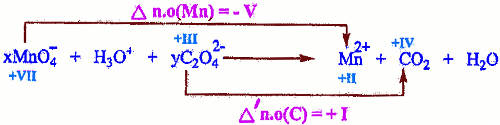 En tenant compte de l’indice du carbone dans \({C_2}O_4^{2 - }\) on a :
En tenant compte de l’indice du carbone dans \({C_2}O_4^{2 - }\) on a :
\(x\Delta n.o\) \( + 2y\Delta n.o\) \( = 0\)
\(x( - V)\) \( + 2y( + I)\) \( = 0\)
On trouve donc :
\(\left\{ \begin{array}{l}x = 2\\y = 5\end{array} \right.\)
En remplaçant x et y et en tenant compte de la conservation des atomes et des charges électriques
\(2MnO_4^ - \) \( + 16{H_3}{O^ + }\) \( + 5{C_2}O_4^{2 - }\) \( \to \) \(2M{n^{2 + }} + \) \(10C{O_2}\) \( + 24{H_2}O\) 0,5 pt
1.3.1 Couples Oxydant/Réducteur mis en jeu 0,25 x2=0,5 pt
\(F{e^{2 + }}/Fe\)
\({H_3}{O^ + }/{H_2}\)
1.3.2 Demi-équations électroniques correspondante à chaque couple
\(Fe\) \( \to \) \(F{e^{2 + }}\) \( + 2{e^ - }\)
\({H_3}{O^ + } + \) \(2{e^ - }\) \( \to \) \({H_2} + \) \(2{H_2}O\)
1.3.3 Équation-bilan de la réaction 0,5pt
\(Fe + \) \(2{H_3}{O^ + }\) \( \to \) \(F{e^{2 + }} + \) \({H_2} + \) \(2{H_2}O\)
1.3.4 Oxydant fort : \({H_3}{O^ + }\) ; Réducteur fort : \(Fe\) 0,25x2=0,5 pt
1.3.5 Gaz dégagée : dihydrogène
1.3.6 Calcule du volume de ce gaz
D’après l’équation bilan,
\({n_{Fe}} = {n_{{H_2}}}\) \( \Rightarrow \) \({V_{{H_2}}} = \) \(\frac{{{m_{Fe}} \times Vm}}{{{M_{Fe}}}}\) 0,25 pt
AN : \({V_{{H_2}}} = 1,29\) L 0,25 pt
1.3.7 Montrons que l’acide chlorhydrique était en excès :
\(\frac{{{n_{{H_3}{O^ + }}}}}{2} = 0,1\) mol/L
\(\frac{{{n_{Fe}}}}{1} = \) \(5,3 \times {10^{ - 2}}\) mol/L 0,25pt
\(\frac{{{n_{Fe}}}}{1} \prec \frac{{{n_{{H_3}{O^ + }}}}}{2}\) Donc l’acide chlorhydrique était en excès 0,25pt
1.4.1 Représentation conventionnelle de la pile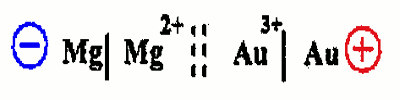 1.4.2 Polarité 0,25x2=0,5 pt
1.4.2 Polarité 0,25x2=0,5 pt
• Pôle positif : Électrode d’or
• Pôle négatif : Électrode de magnésium
1.4.3 Calcule de la force électromotrice 0,25pt
\(E = \) \({E^o}(A{u^{3 + }}/Au)\) \( - {E^o}(M{g^{2 + }}/Mg)\)
\(E = 3,87\) V
1.4.4 Équation–bilan de fonctionnement de la pile
Pôle négatif : \(Mg \to \) \(M{g^{2 + }} + \) \(2{e^ - }\) 0,25 pt
\(A{u^{3 + }} + \) \(3{e^ - }\) \( \to Au\)
1.4.5 Équation-bilan de fonctionnement de la pile
\(3Mg + \) \(2A{u^{3 + }}\) \( \to \) \(3M{g^{2 + }}\) \( + 2Au\)
2. Engrais
2.1 Engrais ternaire : Engrais renfermant trois éléments fertilisant N,P et K 0,25 pt
2.2.1 Trois éléments fertilisants indispensables pour la fertilisation du sol
L’azote, le phosphore et le potassium 0,25x3=0,75 pt
2.2.2. Cinq noms des principaux ions apportés par les engrais chimiques 0,25x5= 1,25 pt
Ion phosphate, Ion nitrate, Ion potassium, Ion ammonium, Ion hydrogénophosphate, ion sulfate …
Exercice III Type expérimental
1. Schéma annoté du dispositif expérimental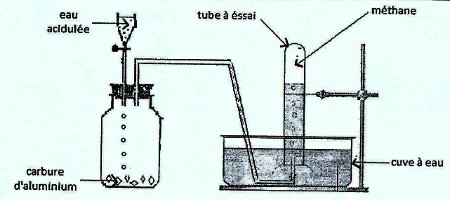 2. Équation–bilan de la réaction
2. Équation–bilan de la réaction
\(A{l_4}{C_3}\) \( + 12{H_2}O\) \( \to 3C{H_4}\) \( + 4Al{(OH)_3}\) 1pt
3. Pour amorcer ou accélérer cette réaction, il faut plonger le flacon contenant le mélange (carbure d’aluminium + eau acidulée) dans l’eau tiède (peu chaude) 0,5pt
4. Verrerie dans laquelle est recueilli le méthane : Tube à essai ou éprouvette 0,5pt
5. État physique de ‘hydroxyde d’aluminium : état solide 0,5 pt


