Partie A : Évaluation des ressources : 24 points
Exercice 1 : Vérification des savoirs : 8 points
1- Définir : Alcool ; Oxydation ménagée 2pt
2- Donner deux caractéristiques de la réaction entre un acide fort et une base faible. 1pt
3- QCM. Choisir la réponse juste :
3-1- Un alcool qui ne subit pas une oxydation ménagée est un alcool : 1pt
a) primaire;
b) secondaire ;
c) tertiaire.
3-2-En présence de la liqueur de Fehling les aldéhydes forment un précipité de couleur : 1pt
a) bleue;
b) rouge brique ;
c) Jaune.
3-3-Pour une solution acide faible HA, le pH est donné par la relation : 1 pt
(a) \(pH = pKa + \) \(\log \frac{{\left[ {HA} \right]}}{{\left[ {{A^ - }} \right]}}\) ;
(b) \(pH = pKa + \) \(\log \frac{{\left[ {{A^ - }} \right]}}{{\left[ {HA} \right]}}\)
(c) \(pH = pKa + \) \(\log \frac{{\left[ {{A^ - }} \right]}}{{\left[ {{H_3}{O^ + }} \right]}}\).
4- Écrire la formule générale des acides alpha –aminés. 2 pts
Exercice 2 : Application des savoirs : 8 points
1- Un acide carboxylique de formule \({C_n}{H_{2n}}{O_2}\) a pour densité de vapeur d = 2,55. Trouver sa formule brute.
On donne les masses molaires en g/ mol : C : 12 ; O : 16 ; H :1 2pts
2- Nommer le composé suivant : 1pt 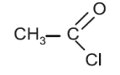 3- On réalise une pile argent-nickel en associant une lame de nickel Ni plongeant dans une solution de sulfate de nickel\(\left( {N{i^{2 + }} + SO_4^{2 - }} \right)\) à une lame d’argent \(Ag\) plongeant dans une solution de nitrate d’argent \(\left( {A{g^ + } + NO_3^ - } \right)\).
3- On réalise une pile argent-nickel en associant une lame de nickel Ni plongeant dans une solution de sulfate de nickel\(\left( {N{i^{2 + }} + SO_4^{2 - }} \right)\) à une lame d’argent \(Ag\) plongeant dans une solution de nitrate d’argent \(\left( {A{g^ + } + NO_3^ - } \right)\).
On donne \({E^o}(A{g^ + }/Ag)\) \( = 0,80V\); \({E^o}(N{i^{2 + }}/Ni)\) \( = - 0,23V\).
3-1-Donner la représentation conventionnelle de cette pile. 2pt
3-2 - Calculer la f.é.m de cette pile 1pt
4-On considère l’équation suivante : \(Mg + {H_3}{O^ + }\) \( \to M{g^{2 + }} + {H_2}\) \( + {H_2}O\)
Équilibrer cette équation- bilan et préciser l’oxydant et le réducteur 2pt
Exercice 3 : Utilisation des savoirs : 8 points
Le pH d’une solution d’acide nitrique de concentration \(C = {10^{ - 2}}mol/L\) est égal à 2 à 25°C.
1. Montrer que l’acide nitrique est un monoacide fort.
Écrire son équation de dissolution. 2pt
2. Calculer les concentrations molaires de tous les ions de cette solution. 2pt
3-Par oxydation ménagée d’un composé organique A, on obtient un composé B qui donne un précipité jaune avec la 2.4- DNPH, et fait rosir le réactif de Schiff.
3-1- Donner la nature de chacun des corps B et A. 2pt
3-2- On ajoute à B une solution de dichromate de potassium en milieu acide, la solution devient verte et on obtient l’acide 2-méthylpropanoïque . Ecrire les formules semi-développées de A et B. 2pt
Partie B : Évaluation des compétences : 16 points
Le boutiquier du quartier ABOKI a trouvé dans son étagère une boite de beurre non vendue
et déposée il y a un an. Doutant de sa qualité, il demande à son fils BANDA, élève en terminale TI de vérifier si ce beurre est devenu rance c'est-à-dire s’il a déjà une odeur piquante.
Un beurre est rance si le pourcentage en masse d’acide butanoïque qu’il contient est supérieur à 4%, c’est-à-dire qu’il y a plus de 4 g d’acide butanoïque dans 100 g de beurre.
Opérations effectuées BANDA
• Dissolution de 10 g du beurre préablement fondu dans un litre d’eau distillée et obtention d’une solution S d’acide butanoïque \({C_3}{H_7}C{O_2}H\) de concentration CA.
• Dosage de 10 mL de la solution S contenant l’acide butanoïque \({C_3}{H_7}C{O_2}H\) par une solution aqueuse d’hydroxyde de sodium \(\left( {N{a^ + } + H{O^ - }} \right)\) de concentration \({C_B} = 4 \times {10^{ - 3}}mol/L\).
On considéra que seul l’acide butanoïque \({C_3}{H_7}C{O_2}H\) réagit avec l’hydroxyde de sodium. Courbe obtenue :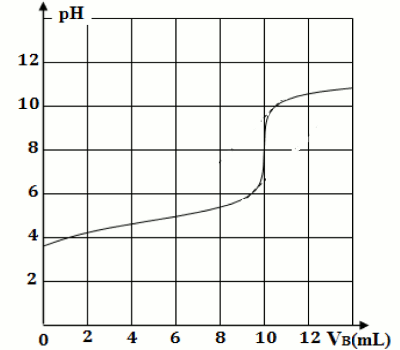 On donne les masses molaires en g/mol : C : 12 ; O : 16 ; H :1
On donne les masses molaires en g/mol : C : 12 ; O : 16 ; H :1
En utilisant des connaissances et en effectuant des calculs,
1- Propose un protocole expérimental du dosage réalisé. 8 pt
2-Dire si le beurre trouvé au magasin est rance. 8 pt


