Partie A : Évaluation des Ressources / 24 points
Exercice 1 : Vérification des savoirs / 8 points
1. Couple acide base : Ensemble constitué de deux espèces acide et base tous conjugués. 1 pt
Teinte sensible : couleur prise par un indicateur coloré dans sa zone de virage.
2. QCM :
2.1 : b (alcool secondaire) ; 0,5 pt
2.2 : c (basique) 0,5 pt
3. Amphion ou Zwitterion 1 pt
4. Formule générale des amides N,N-disubstitués :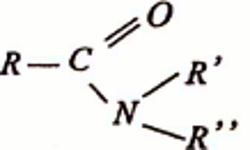 R’ et R’’ sont des groupes carbonés
R’ et R’’ sont des groupes carbonés
5. Deux caractéristiques de la réaction d'estérification entre un acide carboxylique et un alcool : Lente, athermique, réversible ou limitée. 0,5 x 2 = 1 pt
6. Un facteur cinétique et son influence sur la vitesse de formation d'un produit.
• La concentration initiale des réactifs : La vitesse de formation d'un produit augmente avec la concentration initiale des réactifs.
• La température : La vitesse de formation d'un produit augmente avec la température du milieu réactionnel.
• Le catalyseur : Il accélère la vitesse de formation d'un produit lorsqu'il est présent
Exercice 2 : Application des savoirs / 8 pointS
1. Formules semi-développées des composés: 2-1. La nature des corps B et A.
2-1. La nature des corps B et A.
A : Alcool primaire 0,5 pt
B : Aldéhyde 0,5 pt
2-2. Formules semi-développées de A et B si l'oxydation de B donne l'acide 2-méthylpropanoïque.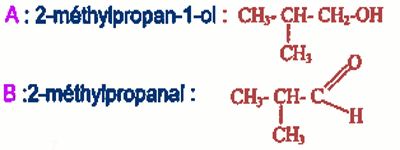 3-Solution d'acide benzoïque \({C_6}{H_5}COOH\) (\(C = {10^{ - 2}}\) mol/L et \(pH = 3,2\) à \(25{}^oC\)).
3-Solution d'acide benzoïque \({C_6}{H_5}COOH\) (\(C = {10^{ - 2}}\) mol/L et \(pH = 3,2\) à \(25{}^oC\)).
3-1- Montrons que l'acide benzoïque est un acide faible.
\(\left[ {{H_3}{O^ + }} \right] = \) \({10^{pH}} = \) \(6,3 \times {10^{ - 4}}\) mol/L or \(C = {10^{ - 2}}\) mol/L
\(\left[ {{H_3}{O^ + }} \right] \prec C\) donc l'acide benzoïque est un acide faible. 1 pt
3.2 Equation-bilan de la réaction avec l’eau
\({C_6}{H_5}COOH + \) \({H_2}O \) \( \to \) \({C_6}{H_5}CO{O^ - } + \) \({H_3}{O^ + }\) 1 pt
3.3 Expression de la constance d’acidité Ka
\(Ka = \) \(\frac{{\left[ {{C_6}{H_5}CO{O^ - }} \right]\left[ {{H_3}{O^ + }} \right]}}{{\left[ {{C_6}{H_5}COOH} \right]}}\) 1 pt
Exercice 3 Utilisation des savoirs / 8 points
1.1 Courbe donnant \(\left[ {{I_2}} \right] = f(t)\) 2 pts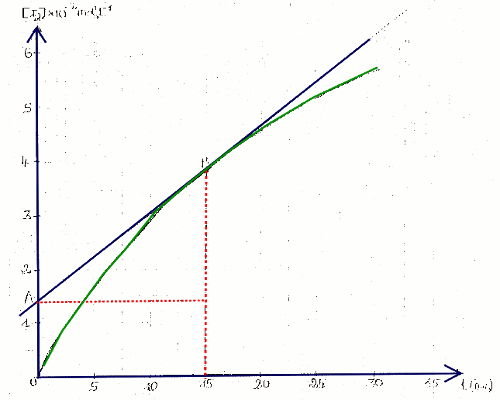 1.2 Vitesse formation de \({{I_2}}\) à \(t = 15\) min
1.2 Vitesse formation de \({{I_2}}\) à \(t = 15\) min
Détermination graphique ( voir image plus haut)
En traçant la tangente a la courbe a \(t = 15\) min, on trouve la pente qui est \(V\left( {{I_2}} \right)\) ainsi :
\(V\left( {{I_2}} \right) = \) \(\frac{{\left( {3,85 - 1,4} \right) \times {{10}^{ - 2}}}}{{\left( {15 - 0} \right)}}\) \( = 1,6 \times {10^{ - 2}}\) mol/L.min 2 pts
1.3 Relation entre la vitesse de formation de \({{I_2}}\) et la vitesse de disparition de \({I^ - }\)
D’après l’équation-bilan de la réactions
\(\frac{{V{{\left( {{I^ - }} \right)}_t}}}{2} = \) \(\frac{{V{{\left( {{I_2}} \right)}_t}}}{1} \Rightarrow \) \(V{\left( {{I^ - }} \right)_t} = \) \(2V{\left( {{I_2}} \right)_t}\) 1 pt
AN : \(V{\left( {{I^ - }} \right)_t} = \) \(2 \times 1,6 \times {10^{ - 3}} = \) \(3,2 \times {10^{ - 3}}\) mol/L.min 1 pt
2. La vitesse de formation du diiode diminue au cours du temps. 1pt
3- Justification de cette opération. 1pt
Cette opération appelée trempe, permet de bloquer ou stopper la réaction afin de doser le diiode présent.
Partie B : Évaluation des Compétences / 16 points
1- Protocole permettant d’aboutir au point de demi-équivalence
Dosage pH-métrique d'une solution d'acide faible All par une base l'une \(H{O^ - }\)
♦ Après avoir rincé la verrerie,
♦ Introduire un volume Va de la solution d'acide faible dans un bûcher ;
♦Introduire la solution de base forte dans la burette graduée jusqu'à la graduation zéro (0);
♦Plonger les électrodes du pH-mètre préalablement étalonné dans le bécher:
♦ Mettre en marche l’agitateur magnétique ;
♦ Verser progressivement la solution de base forte dans le bécher ;
♦ Noter chaque fois la valeur du pH indiquée par le pH-mètre correspondant au volume de base versé ;
A l'aide des résultats obtenus, tracer la courbe \(pH = f(Vb)\) ;
♦ Déterminer le volume à l'équivalence \(V{b_E}\); par la méthode des tangentes parallèles ;
♦ Calculer le volume a la demi-équivalence \(Vb\left( {\frac{1}{2}eq} \right) = \frac{{V{b_{eq}}}}{2}\) de base à verser
♦ Reprendre le dosage en laissant couler un volume \(\frac{{V{b_{eq}}}}{2}\) de la solution de base forte dans le bécher contenant le volume Va initial de la solution d'acide faible et lire le pH correspondant au mélange obtenu. 1,5 pt
Dispositif expérimental.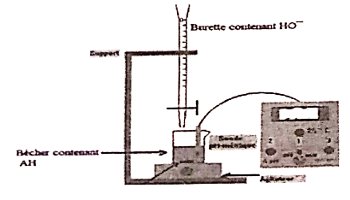 2- Le problème posé : Préparation d'une solution tampon de \(pH = 9,2\)
2- Le problème posé : Préparation d'une solution tampon de \(pH = 9,2\)
\(pH = pKa + \) \(\log \frac{{\left[ {N{H_3}} \right]}}{{\left[ {NH_4^ + } \right]}}\) \( = 9,2 = \) \(pKa\left( {NH_4^ + /N{H_3}} \right)\) 0,5 pt
1| faut que \({\left[ {NH_4^ + } \right] = \left[ {N{H_3}} \right]}\) pour avoir \(pH = pKa\).
N'ayant pas les ions \({NH_4^ + }\) en solution, il faut les produire en faisant réagir \({N{H_3}}\) avec \({H_3}{O^ + }\). suivant l'équation de la réaction :
\(N{H_3} + {H_3}{O^ + }\) \( \to NH_4^ + + \) \({H_2}O\) 0,5 pt
Réactif à choisir : Ammoniac et acide chlorhydrique.
Il faut doser l’ammoniac par l'acide chlorhydrique jusqu'à la demi- équivalence 1,5 pt
Calcul des volumes l'acide et de base à prélever
A la demi-l’équivalence, on a :
\({n_{{H_3}{O^ + }}} = \frac{{{n_{N{H_3}}}}}{2}\) \( \Rightarrow {C_1}{V_1} = \) \(\frac{{{C_2}{V_2}}}{2}\) 1 pt
Alors \(\left\{ \begin{array}{l}{V_1} + {V_2} = 150\\{V_1} = \frac{{{V_2}}}{2}\end{array} \right.\)
Car, ces solutions ont une même concentration
On trouve \({V_1} = 50\) mL et \({V_2} = 100\) mL 1 pt
Pour répondre au besoin de la commande, ATEBA doit :
Réaliser dans un bécher un mélange 50 mL de solution d’acide chlorhydrique et 100 mL de solution d'ammoniac. 1 pt
Ou bien il doit introduire 100 mL de solution d’ammoniac dans un bécher puis à l’aide d'une burette laisser couler 50 mL de solution d'acide chlorhydrique. 1 pt
Le mode de préparation de la solution tampon commandé peut être acheminé au principal du collège Bilingue les COMPÉTENTS 1 pt



