Partie I ; Évaluation des ressources / 24 points
Exercice I : Vérification des savoirs / 8 points
1-Définir : Zwitterion ; énantiomères. 2pt
2- Choisir la bonne réponse parmi celles proposées :
2-1-L’oxydation ménagée d’un aldéhyde avec un oxydant en excès aboutit à : 0,5pt
(a) : une cétone ;
(b) : un acide carboxylique;
(c): un mélange de cétone et d’acide carboxylique.
2-2- A propos d’un mélange racémique : 0,5 pt
(a) : Il est optiquement actif ;
(b) : il est constitué de dextrogyre ou de lévogyre;
(c): il n’est pas doué d’un pouvoir rotatoire.
3-Donner deux caractéristiques de la réaction de saponification. 1 pt
4-Au cours de l’expérience de la lampe sans flamme, dire pourquoi le fil de cuivre reste incandescent. 1 pt
5-La présence du doublet libre dans la structure des aminés leur confère un double caractère : citer ces caractères. 1 pt
6- On donne : \(pKa = (NH_4^ + /\) \(N{H_3}) = 9,2\) et \(pKa = ({C_6}{H_5}COOH\) \(/{C_6}{H_5}CO{O^ - })\)
ô-l-Identifier l’acide faible le plus fort et la base faible la plus forte. 1 pt
6-2 Choisir dans la liste suivante les deux réactifs à utiliser pour préparer un tampon de \(pH = 4,2\). 1 pt
\({C_6}{H_5}COOH\), \(NH_4^ + + C{l^ - }\), \({C_6}{H_5}CO{O^ - }\), \(N{a^ + } + O{H^ - }\) et \(N{H_3}\)
Exercice 2 : Application des savoirs : 8 points
1-On considère les composés suivants : 1-1-Nommer ces deux composés suivant les règles de l’UICPA. 2 pt
1-1-Nommer ces deux composés suivant les règles de l’UICPA. 2 pt
1- 2- Ecrire une équation-bilan permettant d’obtenir le composé ii). 1 pt
2- L’action du chlorure de thionyle \(SOC{l_2}\) sur un composé organique A aboutit au chlorure de propanoyle \(C{H_3} - C{H_2}\) \( - COCl\).
2-1- Donner la formule semi-développée de A. 1 pt
2-2-Le chlorure de propanoyle réagit avec la diméthylarnine et donne un composé B. Ecrire l’équation-bilan de la réaction puis dire à quelle famille appartient B. 2pt
3-Une solution centimolaire (\(C = {10^{ - 2}}\) mol/L) d’ammoniac NH; a un pH égal à 10,6 à \({25^o}\) C.
3-1- Montrer que cette solution est une base faible. 1 pt
3-2- Ecrire l’équation-bilan de la réaction de l'ammoniac avec l’eau. 1 pt
Exercice 3 : Utilisation des savoirs : 8 points
l-La réaction entre les ions iodures (I') et les ions péroxodisulfate (\({S_2}O_8^{2 - }\)) est lente. Elle aboutit à la formation du diiode et des ions sulfate.
Écrire l’équation-bilan de cette réaction. 1 pt
2- A l’instant t = 0 on mélange un volume V; = 500 mL d’une solution de péroxodisulfate de sodium de concentration C1 = 0,1 moL/L et un volume V2 = 500 mL d’une solution d’iodure de potassium de concentration C2 = C1.
21 Déterminer la concentration des ions péroxodisulfate \(\left[ {{S_2}O_8^{2 - }} \right]\) à t = 0. 1 pt
2-2-A intervalles de temps réguliers, on effectue des prélèvements à volumes égaux du mélange réactionnel que l’on verse chaque fois dans un erlenmeyer et l’ensemble est ensuite plongé dans un bain de glace. Le diiode formé progressivement est alors dosé par les ions thiosulfate.
2-2-1- Pourquoi plonge-t-on les prélèvements dans un bain de glace ? 1 pt
2-2-2- Nommer cette opération et préciser le facteur cinétique mis en évidence. 1 pt
2-3- Montrer que l’expression qui lie les concentrations des ions péroxodisulfate et du diiode à un instant test donnée par la relation suivante : \({\left[ {{S_2}O_8^{2 - }} \right]_t} = \) \(50 - {\left[ {{I_2}} \right]_t}\), avec les concentrations exprimées en mmoL/L. 1 pt
3- Aux instants \({t_1} = 4,5\) min et \({t_1} = 9\) min, les concentrations du diiode ont pour valeurs respectives \({\left[ {{I_2}} \right]_1} = 4,5\) mmoL/L et \({\left[ {{I_2}} \right]_2} = 9,5\) mmoL/L.
3.1- Déterminer la vitesse volumique moyenne de disparition des ions péroxodisulfate entre ces deux instants. 2pt
3-2- En déduire la vitesse volumique moyenne de formation des ions sulfate \(SO_4^{2 - }\). 1 pt
Partie B : Évaluation des compétences : 16 points
Papa NOUMBI est arrivé en ville afin de rendre visite à sa fille nouvellement mariée. Comme provision il lui a apporté une dame- jeanne remplie de lait de vache extrait il y a deux jours du village.
A cause de l’état de la route, les pannes du car et autres tracasseries, le voyage s’est effectué en deux jours et sa fille doute déjà de la qualité du lait. Elle se propose de vérifier sa fraîcheur avant la consommation.
Les informations trouvées sur le lait et sa fraîcheur, les opérations effectuées et les résultats obtenus par la fille au laboratoire sont consignés dans les tableaux suivants :
Informations :
Un lait frais est constitué en majorité du lactose:
Au cours du temps, le lactose présent dans le lait se transforme en acide lactique de formule semi-développée suivante :
\(\begin{array}{*{20}{c}}{C{H_3} - }&{CH - }&C&{ = 0}\\{}&|&|&{}\\{}&{OH}&{OH}&{}\end{array}\)-Un lait est frais si sa concentration en acide lactique est inférieure à 1,8 g/L.
Opérations effectuées :
Dosage de VA = 20 mL d’une solution légèrement diluée du lait par une solution d’hydroxyde de sodium \(N{a^ + } + H{O^ - }\) de concentration \({C_B} = 5 \times {10^{ - 2}}\) moL/L.
Utilisation de la phénolphtaléine :
| Incolore | 8,8 -- 10 | Rouge violacé |
-Utilisation de Peau distillée et de toutes autres verreries usuelles.
Résultats obtenus : ( \({V_B}\) étant le volume de \(N{a^ + } + H{O^ - }\) versé)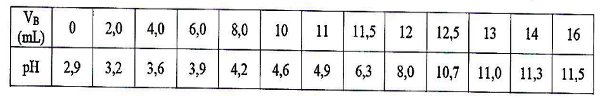 En mettant en exergue tes connaissances en chimie et en t’appuyant sur un graphique, '
En mettant en exergue tes connaissances en chimie et en t’appuyant sur un graphique, '
l. Propose un protocole expérimental permettant d’obtenir les valeurs du tableau et de repérer la zone d’équivalence acido-basique. 6 pt
2 Donne ton avis sur la fraicheur du lait apporté par le père. 10 pt
On donne en g/mol: C:l2; O:16; H :l.


