Instruction
Pour chaque question ci-dessous choisissez la réponse correcte parmi les options proposées.
51 Laquelle parmi les solutions ci-dessous possède la concentration la plus élevée d’ions hydroxyde ?
a. 0.1MHCl ;
b. 0.1M \({H_2}S{O_4}\) ;
c. Solution de pH = 5
d. Solution de pH = 12
e. Eau pure
52 Laquelle parmi les équations chimiques ci-dessous est fausse ?
a. \({C_5}{H_6}COOH + \) \({H_2}O \to {C_5}{H_6}CO{O^ - }\) \( + {H_3}{O^ + }\) ;
b. \(HN{O_3} + {H_2}O\) \( \to NO_3^ - + {H_3}{O^ + }\) ;
c. \(HCl + {H_2}O\) \( \to C{l^ - } + {H_3}O + \) ;
d. \({H_2}S{O_4} + 2{H_2}O\) \( \to 2{H_3}{O^ + }\) \( + SO_4^{2 - }\) ;
e. Aucune des réponses ci-dessus.
53 Quelle est la concentration totale de \(C{O_2}\) dissoute dans le sang ?
a. \(2,65 \times {10^{ - 2}}\) M ;
b. \(5,7 \times {10^{ - 2}}\) M
c. \(3,65 \times {10^{ - 3}}\)M
d. \(7,7 \times {10^{ - 2}}\) M
e. \(2,65 \times {10^{ - 6}}\) M
54 Quelles sont les concentrations respectivement du \(C{O_2}\) et \(HC{O_3}\) dissous ?
a. \(2,53 \times {10^{ - 2}}\) M et \(1,21 \times {10^{ - 2}}\)M ;
b. \(1,21 \times {10^{ - 3}}\) M et \(2,53 \times {10^{ - 2}}\) M ;
c. \(1,325 \times {10^{ - 2}}\) M et \(1,325 \times {10^{ - 3}}\)M ;
d. \(2,53 \times {10^{ - 2}}\) et \(1,21 \times {10^{ - 3}}\) M.
e. Aucune des réponses ci-dessus
55 Quelle est la pression partielle du CO 2 dissous en mm Hg ?
a. 20, 11 mmHg
b. 84, 02 mmHg
c. 45, 75 mmHg
d. 40, 22 mmHg
e. 35, 22 mmHg
56 Quelle substance est représentée par la formule : \({H_2}C = C{H_2}\) ?
a. Butane
b. Propane
c. Éthène
d. Méthane
e. Acétylène
57 Considérer les substances organiques dont les structures (1) et (2) sont présentées ci- dessous :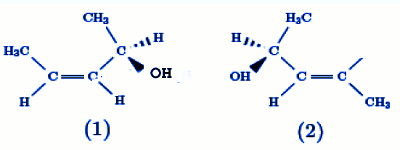 Les substances avec structures (1) et (2) sont :
Les substances avec structures (1) et (2) sont :
a. Isomères de position
b. Isomères en chaines
c. Énantiomères
d. Diastéréo-isomères
e. Images en miroir de chacune
Un voltmètre est relié à une batterie de fer-cuivre. Le schéma du circuit de la batterie est : \(( - )Fe(S)/\) \(F{e^{2 + }}C{u^{2 + }}/\) \(Cu(S)( + )\).
La différence de potentiel mesurée par le voltmètre est U = 0, 76V.
58 Á quel des électrodes a-t-on relié le terminal V du voltmètre ?
a. Électrode en argent
b. Électrode en cuivre
c. Électrode en fer
d. Électrode en or
e. Aucune des réponses ci-dessus
59 Quelle est la valeur de la force électromotrice (f.é.m.) de cette batterie ?
a. 1, 26V ; b. 1, 24V ; c. 1, 23V ; d. 1, 22V ; e. 0, 76V.
60 L’énergie d’ionisation d’un atome est :
a. Le nombre d’électrons sur la couche la plus externe de l’atome
b. La facilité avec laquelle un atome peut perdre un électron
c. La facilité avec laquelle les atomes peuvent se combiner pour former des molécules
d. La charge sur le noyau
e. Aucune des réponses ci-dessus
61 Quelles particules élémentaires sont les contributeurs principaux de la masse d’un atome
a. Protons et électrons
b. Neutrons et électrons
c. Protons et neutrons
d. Tous les précédents
e. Aucune des réponses ci-dessus
La réaction chimique suivante est exothermique dans sa phase gazeuse :
\({N_2} + 3{H_2}\) \( \leftrightarrow 2N{H_2}\)
Que se passera-t-il dans les circonstances suivantes ?
62 Quand la température est augmentée
a. L’équilibre est déplacé vers la droite
b. L’équilibre est déplacé vers la gauche
c. L’équilibre est déplacé vers la droite et vers la gauche
d. Il y a une explosion
e. Rien n’arrive ou rien ne se passe
63 Quand la pression est augmentée :
a. La marche de réaction en avant est favorisée
b. La marche de réaction rétrogradée est favorisée
c. La réaction va de L’avant puis en arrière
d. Il y a une explosion
e. Rien ne se passe
64 Le numéro atomique de l’uranium est 92. Combien d’électrons et de protons respectivement sont présents dans l’ion \({U^{2 + }}\)
a. 90 et 90 ;
b. 92 et 92 ;
c. 90 et 92 ;
d. 92 et 90 ;
e. 94 et 92.
65 Le noyau de l’atome de plomb est représenté par le symbole \({}_{82}^{207,3}Pb\). On donne :
| Particule | Particule | Charge |
| Proton | \({m_p} = 1,67 \times {10^{ - 27}}\) kg, | \({q_p} = + 1,60 \times {10^{ - 19}}\) C |
| Neutron | \({m_n} = + 1,67 \times {10^{ - 27}}\) | \({q_n} = 0\) C |
| Électron | \({m_e} = 9,11 \times {10^{ - 31}}\) | \({q_e} = - 1,60 \times {10^{ - 19}}\)C |
La charge de cet atome est :
a. 82C
b. \(1,31 \times {10^{ - 17}}\) C ;
c. \(1,312 \times {10^{ - 17}}\) C ;
d. \(3,315 \times {10^{ - 17}}\) C ;
e. 0 C.
66 Le niveau d’énergie de l’atome d’hydrogène est donné par la relation \({E_n} = \frac{{13,6}}{{{n^2}}}\) où n est un nombre entier non nul et \({E_n}\) l’énergie en eV du niveau n. On donne :
constante de Planck : \(h = 6,63 \times {10^{ - 34}}\) J.s ;
célérité de la lumière dans le vide : \(c = 3 \times {10^{ 8}}\) m/s ;
1eV = \(1,6 \times {10^{ - 19}}\) J.
La plus courte longueur d’onde de la série de Balmer est :
a. 365, 6nm ;
b. 91, 4nm ;
c. 658, 1nm ;
d. 121, 9nm ;
e. 487, 5nm ;
67 Le passage de l’atome d’hydrogène du niveau d’énergie \(n\) au niveau d’énergie \(n’\) inférieur à \(n\) correspond à :
a. une émission de photon
b. une absorption de photon
c. une absorption ou une émission de photon
d. l’ionisation de l’atome
e. aucune réponse juste.
68 On donne les potentiels standards d’oxydoréduction de quelques couples :
• \(H{g^{2 + }}/Hg\) \(\left( {{E^o} = 0,86V} \right)\);
• \(P{b^{2 + }}/Pb\) \(\left( {{E^o} =- 0,13V} \right)\);
• \(S{n^{2 + }}/Sn\) \(\left( {{E^o} = -0,14V} \right)\);
La réaction naturelle et totale que l’on peut avoir à partir de ces couples est :
a. \(P{b^{2 + }} + Sn\) \( \to S{n^{2 + }} + Pb\) ;
b. \(S{n^{2 + }} + Pb \to \) \(P{b^{2 + }} + Sn\) ;
c. \(P{b^{2 + }} + Hg \to \) \(H{g^{2 + }} + Pb\) ;
d. \(S{n^{2 + }} + Hg \to \) \(H{g^{2 + }} + Sn\) ;
e. \(H{g^{2 + }} + Pb \to \) \(P{b^{2 + }} + Hg\).
69 Au cours d’une réaction d’oxydoréduction :
a. l’oxydant s’oxyde et le réducteur se réduit
b. le réducteur et l’oxydant s’oxydent
c. le réducteur et l’oxydant se réduisent
d. le réducteur s’oxyde en captant des électrons
e. aucune réponse juste
70 Une solution d’acide lactique de concentration 0, 025 mol/L a un pH de 2,75. Quelle est la constante d’acidité de l’acide lactique?
a. \(1,26 \times {10^{ - 4}}\) ;
b. \(1,36 \times {10^{ - 4}}\) ;
c. \(1,78 \times {10^{ - 3}}\) ;
d. \(7,11 \times {10^{ - 2}}\) ;
e. \(7,66 \times {10^{ - 2}}\).
71 Le paracétamol est obtenu par action du paraaminophénol (formule 1) sur l’anhydride éthanoïque (formule 2). On suppose que le groupe -OH du paraaminophénol se comporte comme une fonction alcool et que la fonction amine réagit avant la fonction alcool.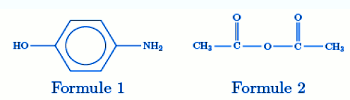 Si l’anhydride éthanoïque est en excès dans le milieu réactionnel, en plus de la réaction de synthèse du paracétamol, il se produira aussi une réaction :
Si l’anhydride éthanoïque est en excès dans le milieu réactionnel, en plus de la réaction de synthèse du paracétamol, il se produira aussi une réaction :
a. Acido-basique
b. D’hydrolyse
c. De saponification
d. D’oxydoréduction
e. Aucune réponse juste
72 L’aspirine est un médicament très utilisé au Cameroun. Son nom scientifique est : acide acétylsalicylique. Sa structure est :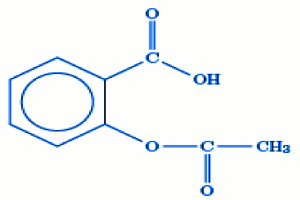 La molécule d’aspirine contient les fonctions chimiques suivantes :
La molécule d’aspirine contient les fonctions chimiques suivantes :
a. Acide carboxylique et alcool
b. Acide carboxylique et anhydride d’acide
c. Acide carboxylique et cétone
d. Acide carboxylique et éther
e. Acide carboxylique et ester
73 A l’équilibre, l’estérification de tout alcool et de l’acide éthanoïque donne :
a. 70% d’ester
b. 67% d’ester
c. 60% d’ester
d. 33% d’ester
e. Aucune réponse juste
74 Quelle est la concentration en ions sodium, dans une solution aqueuse de sulfate de sodium obtenue en dissolvant 3,55 g de ce composé dans 200 mL d’eau distillée ?
Données : Na(23), S(32) et O(16).
a. 0, 125 mol/L ;
b. 0, 500 mol/L ;
c. 0, 250 mol/L ;
d. 0, 025 mol/L ;
e. 0, 013 mol/L.
75 Au cours d’une réaction d’estérification, on fait réagir l’acide éthanoïque avec une mole d’éthanol. Le rendement d’estérification de l’éthanol :
a. est de 67% car l’éthanol est un alcool primaire
b. est de 67% car la réaction est lente, limitée et athermique
c. est de 67% car il se forme de l’éthanoate d’éthyle
d. peut être égal, supérieur ou inférieur à 67% suivant la quantité d’acide éthanoïque utilisée
e. Aucune réponse juste


