EXERCICE 1
1- Q.C.M.
1-1 Le groupe amine à une structure géométrique : a) pyramidale
1-2 -La base la plus forte est : d) \(N{H_3}\)
1- Définitions : 1-1. Amine 1-2. Site électrophile. 1-3.Site nucléophile (voir cours)
2- Nommons les composés :
2-1 - N,N-diéthyl-2-phényléthylamine
2-2 - N-éthylpropan-2-amine
2-3 - Pentane-1,2,5-triamine
3- La formule générale d’une amine primaire \(R - N{H_2}\), secondaire \(R - NH - R'\) et tertiaire \(R - NR'R''\).
4- Les amines sont des bases de Bronsted parce qu’elles possèdent un atome d’azote ayant un doublet d’électrons non liant capable de capter un proton.
5 - Classons les composés suivants par ordre de basicité décroissante :
\({(C{H_3})_3}N\) \( \to \) \({(C{H_3})_2}NH\) \( \to \) \(C{H_3} - N{H_2}\) \( \to \) \(N{H_3}\)
6 -1.L’équation-bilan de l’ionisation de l’ionisation de la triéthylamine dans l’eau.
\({({C_2}{H_5})_3}N\) \( + {H_2}O\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({({C_2}{H_5})_3}N{H^ + }\) \( + O{H^ - }\)
- la propriété des amines mise en évidence au cours de cette réaction est la propriété basique.
6-2-1. Écrivons, en explicitant le mécanisme réactionnel, l’équation-bilan de la réaction et nommons le produit de la réaction.
L’atome d’azote de l’amine tertiaire constitue un centre nucléophile alors que l’atome de carbone de l’iodure de méthyle constitue un centre électrophile, il y aura ainsi une réaction de substitution nucléophile :
\({({C_2}{H_5})_3}\mathop N\limits^ - \) \( + C{H_3}I\) \( \to \) \({({C_2}{H_5})_3}N{H^ + }\) \( - C{H_3},{I^ - }\)
Le produit de cette réaction est l’iodure de triéthylméthylammonium
6-2-2. La propriété des amines mise en évidence au cours de cette réaction est la propriété nucléophile.
6-2-3- Le composé précipite car il est un composé ionique insoluble dans le solvant organique qui est l’éther.
6-2-4- Calculons la masse de produit obtenu .Déterminons le réactif limitant :
Soient n1 le nombre de mole de \({({C_2}{H_5})_3}\mathop N\limits^ - \), n2 celui de \(C{H_3}I\) et n3 celui de \({({C_2}{H_5})_3}N{H^ + }\) \( - C{H_3},{I^ - }\)
\({n_1} = \frac{{{m_1}}}{{{M_1}}} = 0,297\) mol, \({n_2} = \frac{{{m_2}}}{{{M_2}}} = 0,246\), donc l’iodoéthane est le réactif limitant d’où
\({n_3} = r.{n_2}\) \( \Rightarrow \) \({m_3} = \) \(r.{n_2}{M_3}\)
\({m_3} = 50,91\) g
7- L’action d’une amine primaire A sur un halogénure d’alcane B conduit après une suite de réaction à l’iodure de triéthylpropylammonium.
7-1- Les noms et les formules semi-développées des composés A et B.
A : \(C{H_3} - \) \(C{H_2} - \) \(C{H_2} - \) \(N{H_2}\) : propanamine
B : \(C{H_3} - \) \(C{H_2} - I\) : iodure d’éthyle
7-2- Les équations-bilans des réactions conduisant à l’iodure de triéthylpropylammonium
\(C{H_3} - \) \(C{H_2} - \) \(C{H_2} - \) \(N{H_2} + \) \({C_2}{H_5} - I\) \( \to \) \(C{H_3} - C{H_2}\) \( - C{H_2}\) \( - NH_2^ + {C_2}{H_5}\) \( + {I^ - }\)
\(C{H_3} - \) \({(C{H_2})_2} - \) \(NH_2^ + {C_2}{H_5}\) \( + C{H_3}\) \( - {(C{H_2})_2}\) \(N{H_2}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(C{H_3} - \) \({(C{H_2})_2}\) \( - NH\) \( - {C_2}{H_5}\) \( - {(C{H_2})_2}\) \(NH_3^ + \)
\(C{H_3} - \) \({(C{H_2})_2} - \) \(N{H^ + }\) \({({C_2}{H_5})_2}\) \( + {C_2}{H_5}\) \( - I\) \( \to \) \(C{H_3} - \) \({(C{H_2})_2} - \) \(N{H^ + }{({C_2}{H_5})_2}\) \( + {I^ - }\)
\(C{H_3} - \) \(C{H_2}{)_2} - \) \(N{H^ + }{({C_2}{H_5})_2}\) \( + C{H_3}\) \( - {(C{H_2})_2}N{H_2}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(C{H_3} - \) \({(C{H_2})_2} - \) \(N{({C_2}{H_5})_2} + \) \(C{H_3}{(C{H_2})_2}NH_3^ + \)
\(C{H_3} - \) \(C{H_2} - \) \(C{H_2} - \) \(N{H_2} + \) \({C_2}{H_5} - I\) \( \to \) \(C{H_3} - \) \(C{H_2} - \) \(C{H_2} - \) \(NH_2^ + {C_2}{H_5}\) \( + {I^ - }\)
Exercice 2
Ecrivons et complétons les réactions :
1.\(C{H_3} - \) \(N{H_2} + \) \(C{H_3} - \) \(CO - \) \(C{H_3}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({H_2}O + \) \(C{H_3} - \) \((C{H_3})CN\) \( - C{H_2}\) \( - C{H_3}\)
2.\(C{H_3}\) \( - CH\) \( - NH\) \( - C{H_3}\) \( + {C_6}{H_5}\) \( - CO\) \( - Br\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(HBr + \) \({C_6}{H_5} - \) \(CO - \) \(NC{H_3} - \) \(C{H_2} - \) \(C{H_3}\)
3. \({H_3}C - \) \(C{H_2} - \) \(NH - \) \({(C{H_2})_4} - \) \(C{H_3} + \) \({H_3}C - \) \(C{H_2} - \) \(COOH\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({H_3}C - \) \(C{H_2} - \) \(CO{O^ - }\) \( + {H_3}C\) \( - C{H_2}\) \( - NH_2^ + \) \( - {(C{H_2})_4}\) \( - C{H_3}\)
4. \({H_3}C - \) \(C{H_2} - \) \(NH - \) \({(C{H_2})_3}\) \( - C{H_3}\) \( + C{H_3}\) \( - CO\) \( - O - \) \(CO - \) \(C{H_3}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(C{H_3} - \) \(CO - \) \(({C_2}{H_5})N\) \( - ({C_4}{H_9})\) \( + C{H_3}\) \( - COOH\)
5. \({C_2}{H_5} - \) \(NH - \) \({C_5}{H_{11}}\) \( + C{H_3}\) \( - COOH\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({C_2}{H_5} - \) \(CO - \) \(({C_2}{H_5})\) \(N({C_5}{H_{11}})\) \( + {H_2}O\)
6.\({C_3}{H_7} - \) \(N{H_2} + \) \(HN{O_2}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({C_3}{H_7} - \) \(OH + \) \({N_2} + \) \({H_2}O\)
7. \(C{H_3} - \) \(NH - \) \({C_3}{H_7} + \) \(HN{O_3}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({H_2}O + \) \(C{H_3} - \) \({N_2}O - \) \({C_3}{H_7}\)
8.\(C{H_3} - \) \(COCl + \) \((C{H_3})\) \(N({C_3}{H_7})\) \( - C{H_3}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) pas de réaction
L’amine est tertiaire, elle ne peut pas réagir avec le chlorure d’éthanoyle.
9. \(CO - \) \(O - \) \({C_2}{H_5} + \) \(C{H_3} - \) \(NH - \) \(C{H_3}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(CO - \) \(C{H_3}NC{H_3}\) \( + C{H_3}\) \( - OH\)
10.\(C{H_3} - \) \(CO - \) \(O - \) \(C{H_3} + \) \(({C_2}{H_5})\) \(C({C_2}{H_5})\) \( - NH\) \( - {C_2}{H_5}\)
L’amine est tertiaire, elle ne peut pas réagir avec l’ester.
Exercice 3
1. Ce test nous informe qu’il s’agit d’une amine primaire. Le principal produit formé est un alcool.
2. C appartient aux aldéhydes et cétones puisqu’il donne un précipité jaune en présence de DNPH. Il s’agit d’un aldéhyde puisqu’il donne un test positif à la liqueur de Fehling (Il est oxydable par un oxydant doux, contrairement à une cétone).
3. D résulte de l’oxydation d’un aldéhyde : il s’agit d’un acide carboxylique, d’où ses propriétés acides.
4. On obtient les réactions suivantes :
Réaction (1) :
\({C_4}{H_9} - \) \(N{H_2} + \) \(HN{O_2}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({C_4}{H_9} - \) \(OH + \) \({H_2}O + \) \({N_2}\)
Réaction (2) :
Demi-équations rédox :
\((MnO_4^ - \) \( + 8{H^ + }\) \( + 5{e^ - }\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(M{n^{2 + }}\) \( + 4{H_2}O\) \() \times 2\)
\(({C_4}{H_8} - \) \(OH\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({C_4}{H_9}O\) \( + 2{H^ + }\) \( + 2{e^ - }) \times 5\)
L’équation bilan devient :
\(5{C_4}{H_8} - \) \(OH + \) \(2MnO_4^ - \) \( + 6{H^ + }\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(5{C_4}{H_9}O\) \( + 2M{n^{2 + }}\) \( + 8{H_2}O\)
Réaction (3) :
Demi-équations redox :
\(MnO_4^ - \) \( + 8{H^ + }\) \( + 5{e^ - }\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(M{n^{2 + }}\) \( + 4{H_2}O\)
\({C_3}{H_7} - \) \(CHO + \) \({H_2}O\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({C_3}{H_7} - \) \(COOH + \) \(2{H^ + } + \) \(2{e^ - }\)
L’équation bilan devient :
\(5{C_3}{H_7} - \) \(CHO + \) \(2MnO_4^ - \) \( + 6{H^ + }\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(5{C_3}{H_7} - \) \(COOH + \) \(2M{n^{2 + }} + \) \(8{H_2}O\)
5. On obtient un amide :
\({C_3}{H_5} - \) \(COOH\) \( + {C_4}{H_9}\) \( - N{H_2}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({C_3}{H_7} - \) \(CO - \) \(NH - \) \({C_4}{H_9} + \) \({H_2}O\)
C’est la N-butylbutanamide.
Exercice 4
1. Test à l’acide nitreux.
a- L’acide nitreux est préparé directement dans le milieu réactionnel par action de l’acide chlorhydrique sur le nitrite de sodium.
b- On obtient :
\(C{H_3} - \) \(NH - \) \(C{H_3} + \) \(HN{O_2}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(C{H_3} - \) \({N_2}O - \) \({C_2}{H_5} + \) \({H_2}O\)
c- On observe une phase liquide ou un solide de couleur jaune qui indique la présence d’une amine secondaire.
2. Equation de réaction :
\(C{H_3} - \) \(NH - \) \({C_2}{H_5} + \) \(C{H_3} - \) \(COCl\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(C{H_3} - \) \(CO - \) \(C{H_3}N{C_2}{H_5}\) \( + HCl\)
On a obtenu un amide : N-ethyl, N-méthyléthanamide.
Exercice 5
1. Alcène.
A - A est le but-2-ène.
\(C{H_3} - C\) \( = C{H_3}\) \( + {O_3} + \) \({H_2}O\) \( \to \) \(2C{H_3}\) \( - CO\) \( + {H_2}{O_2}\)
b- Le zinc sert de réducteur, c’est lui qui réagit avec l’oxydant H2O2, ainsi l’aldéhyde formé n’est pas oxydé.
2. Réaction avec la propanamine.
A - Il s’agit d’une amine primaire.
B - Le teste à l’acide nitreux permet de le mettre en évidence : il y a formation d’une phase liquide ou d’un solide jaune.
C - Réaction : Il y a formation d’une imine.
\(C{H_3} - \) \(C = \) \(O + \) \(C{H_3} - \) \(C{H_2} - \) \(C{H_2} - \) \(N{H_2}\) \( \to \) \(C{H_3} - \) \(C = \) \(N - \) \(C{H_2} - \) \(C{H_2} - \) \(C{H_3} + \) \({H_2}O\)
d- première étape, attaque nucléophile :
\(C{H_3} - \) \(CO + \) \({C_3}{H_7} - \) \(N{H_2}\) \( \to \) \(C{H_3} - \) \(C{O^ - } - \) \(NH_2^ + - \) \({C_3}{H_7}\)
Puis :
\(C{H_3} - \) \(C{O^ - } - \) \(NH_2^ + - \) \({C_3}{H_7}\) \( \to \) \(C{H_3} - \) \(COH - \) \(NH - \) \({C_3}{H_7}\)
Puis déshydratation
\(C{H_3} - \) \(COH\) \( - NH\) \( - {C_3}{H_7}\) \( \to \) \({H_3} - \) \(C = \) \(N - \) \({C_3}{H_7} + \) \({H_2}O\)
Exercice 6
1-1- Déterminons sa formule brute \({C_n}{H_{2n + 3}}N\)
\(\% N = \) \(\frac{{{M_N}.100}}{M}\) \( \Rightarrow n = 3\)
d’où \({C_3}{H_9}N\)
1-2-Donnons la formule semi-développée, le nom et la classe de tous ses isomères.
\(C{H_3} - \) \(C{H_2} - \) \(C{H_2} - \) \(N{H_2}\): propylamine : amine primaire
\({(C{H_3})_2}CH\) \( - N{H_2}\) : propan-2-amine : amine primaire
\(C{H_3} - \) \(C{H_2} - \) \(NH - \) \(C{H_3}\): N-méthyléthanamine : amine secondaire
(\({({C_2}{H_5})_3}N\): triméthylamine : amine tertiaire
2-1- L’équation-bilan de la réaction et le nom du produit formé.
\({({C_2}{H_5})_3}N\) \( + C{H_3}\) \( - I\) \( \to \) \({({C_2}{H_5})_3}{N^ + }\) \(C{H_3} + \) \({I^ - }\)
Soient n1 le nombre de mole de \({({C_2}{H_5})_3}N\), n2 le nombre de mole de \(C{H_3} - I\) et n3 le nombre de mole de \({({C_2}{H_5})_3}\) \({N^ + }C{H_3}\)
2-2- Calcul du rendement de la réaction.
Recherche du réactif limitant :
\({n_1} = \) \(\frac{{{m_1}}}{{{M_1}}} = \) \(0,248\) g, \({n_2} = 0,22\) g donc l’iodométhane est le réactif limitant :
\(r.{n_2} = \) \({n_3} \Rightarrow \) \(r = \) \(\frac{{{m_3}}}{{{n_2}.{M_3}}} = \) \(0,94\)
3-1- Donnons leur formule brute en fonction de n : \({C_n}{H_{2n + 3}}N\)
3-2- Déterminons sa formule brute.
\(\% N = \frac{{2,9}}{{15}}\) \( = \frac{{14}}{{14n + 17}}\) \( \Rightarrow n = 4\)
.D’où la formule brute : \({C_4}{H_{11}}N\)
4-1-Déterminons la concentration C1 de la solution aqueuse d’amine.
L’équation-bilan de la réaction est :
\({C_n}{H_{2n + 3}}N\) \( + {H_3}{O^ + }\) \( \to \) \({C_n}{H_{2n + 3}}N{H^ + }\) \( + {H_2}O\)
A l’équivalence,
\({n_1} = {n_2}\) \( \Rightarrow {C_1} = \) \(\frac{{{C_2}{V_2}}}{{{V_1}}} = 0,2\) mol/L
4-2-1-Déterminons la masse molaire et la formule brute de l’amine tertiaire A.
\({C_1}V = \frac{m}{M}\) \( \Rightarrow \) \(M = \frac{m}{{{C_1}.V}}\)
\(M = 101\) g/mol
soit \({C_6}{H_{15}}N\)
4-2-2-La formule semi-développée de cette amine tertiaire et son nom : \(C{H_3} - \) \(C{H_2} - \) \((C{H_3})CH\) \( - N(C{H_3})\) \( - C{H_3}\)
N,N-diméthylbutan-2-amine
5-Une amine saturée A, a pour formule brute \({C_4}{H_{11}}N\).
5-1-Ecrivons toutes les formules semi-développées des isomères amines primaires et tertiaires, puis nommons-les.
\({C_4}{H_9} - \) \(N{H_2}\) : butan-1-amine,
\(C{H_3} - \) \(C{H_2} - \) \(CH(N{H_2})\) \( - C{H_3}\) : butan-2-amine
\({(C{H_3})_2}CH\) \( - C{H_2}\) \( - N{H_2}\): 2-méthylpropanmine
\(C{H_3} - C{H_2}\) \( - N{(C{H_3})_2}\) : N,N-diméthyléthanamine
5-2-Ecrivons, en explicitant le mécanisme réactionnel ; la réaction du chlorure d’acyle avec une amine primaire. L’atome d’azote de l’amine primaire constitue un centre nucléophile alors que l’atome de carbone de la fonction chlorure d’acyle constitue un centre électrophile, il y aura ainsi une réaction de substitution nucléophile :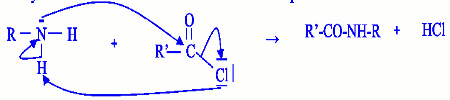 - Cette réaction n’est pas possible avec une amine tertiaire parce que l’atome d’hydrogène fixé sur l’atome d’azote qui participe au mécanisme réactionnel n’existe pas dans les amines tertiaires.
- Cette réaction n’est pas possible avec une amine tertiaire parce que l’atome d’hydrogène fixé sur l’atome d’azote qui participe au mécanisme réactionnel n’existe pas dans les amines tertiaires.
- Le nom de cette amine de cette amine est : N,N-diméthyléthanamine
5-3- En revanche, l’amine A réagit avec l’iodoéthane, en solution dans l’éthanol
5-3-1- L’équation-bilan de cette réaction est :
\(C{H_3} - \) \(C{H_2} - \) \(N{(C{H_3})_2}\) \( + {C_2}{H_5}\) \( - I\) \( \to \) \(C{H_3} - \) \(C{H_2} - \) \({N^ + }{(C{H_3})_2}\) \({C_2}{H_5}\) \( + {I^ - }\)
- Le nom du produit obtenu est : Iodure de diéthyldimétylammonium
5-3-2-Le caractère particulier des amines que cette réaction met en évidence est le caractère nucléophile.
- Ce type de réaction est appelée réaction de substitution nucléophile.

