Objectifs :
- Nommer les amines selon leurs classes
- Montrer le caractère nucléophile et basique des amines.
1. Définition.
Les amines sont considérés comme des composés dérivant de l’ammoniac (NH3) par substitution d’un atome ou plusieurs d’hydrogène par un groupe alkyle ou aryle.
1.1 Structure de la molécule d’ammoniac.
L’ammoniac est une molécule de formule brute NH3. Sa formule de Lewis est :
\(\begin{array}{*{20}{c}}H& - &{\mathop N\limits^ - }& - &H\\{}&{}&|&{}&{}\\{}&{}&H&{}&{}\end{array}\)
L’ammoniac à la forme d’une pyramide aplatie dont le sommet est occupé par l’atome d’azote et la base triangulaire par les atomes d’hydrogènes.
2. Les classes d’amines.
On distingue trois classes d’amines :
♦ L’amine primaire :
Dans cette classe, l’atome d’azote est lié à un groupe carboné, sa formule générale est
R-NH2, Ar-NH2 avec R est un groupement alkyle et Ar un groupement aryle.
Exemple :
\({H_3}C - N{H_2}\),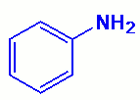
♦ L’amine secondaire :
Dans cette classe l’atome d’azote est fixé à deux groupes carbonés, leurs formules générales sont : R-NH-R’ ; R-NH-R ; Ar-NH-R. ; Ar-NH-Ar.
Exemple :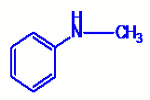 : \({H_3}C - \) \(NH - C{H_3}\)
: \({H_3}C - \) \(NH - C{H_3}\)
♦ L’amine tertiaire :
Dans cette classe d’amine, l’atome d’azote est fixé à trois groupes carbonés. Ses formules générales peuvent être :
\(\begin{array}{*{20}{c}}{}&{}&{Ar}&{}&{}\\{}&{}&|&{}&{}\\{Ar}& - &N& - &{Ar}\end{array}\)
\(\begin{array}{*{20}{c}}{}&{}&R&{}&{}\\{}&{}&|&{}&{}\\R& - &N& - &R\end{array}\)
Exemple
\(\begin{array}{*{20}{c}}{}&{}&{Ph}&{}&{}\\{}&{}&|&{}&{}\\{C{H_3}}& - &N& - &{{C_2}{H_5}}\end{array}\)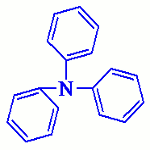
3. Nomenclature des amines.
Pour nommer les amines, deux nomenclatures peuvent être utilisées :
• Le nom de l’amine s’obtient en remplaçant le « e » final de l’hydrocarbure correspondant à la chaine carbonée principale par le suffixe « amine ».
• On peut aussi ajouter le suffixe amine au nom du groupe alkyle correspondant à la chaine carboné principale.
Exemple :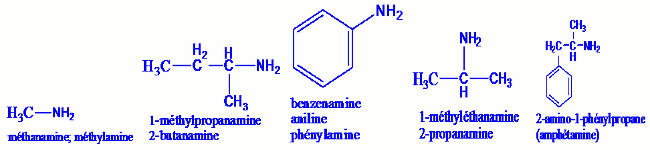 Pour les amines secondaires et tertiaires, deux cas sont à distinguer :
Pour les amines secondaires et tertiaires, deux cas sont à distinguer :
- Les amines symétriques :
Lorsque les groupes carbonés sont identiques on les nomme en ajoutant le suffixe « amine » au nom du groupe carboné tout en précisant le préfixe di, ou tri.
Exemple :
\({({C_6}{H_5})_3}N\)
Triphénylamine
\({C_2}{H_5} - \) \(NH - \) \({C_2}{H_5}\)
Diéthylamine
- Las amines dissymétriques :
Le nom principale d’une amine dissymétrique est celui qui dérive de la chaine carboné principale précédé du préfixe (N-) dans le cas d’une amine secondaire ou (N,N-) dans le cas d’une amine tertiaire.
Exemple :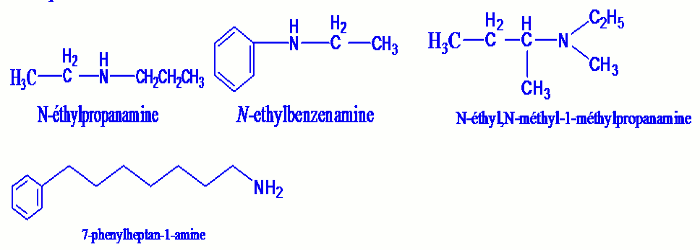 NB : Dans le cas du cycle benzénique, celui-ci est considéré comme substituant lorsque la chaine carbonée aliphatique possède un nombre de carbone supérieur à 6.
NB : Dans le cas du cycle benzénique, celui-ci est considéré comme substituant lorsque la chaine carbonée aliphatique possède un nombre de carbone supérieur à 6.
4. Propriétés physiques des amines.
Les amines primaires et secondaires a cause de leur habileté à former des liaisons par pont hydrogènes possèdent une température d’ébullition plus élevée que les alcanes de même masse moléculaires mais, moins élevée que les alcools correspondant. De plus les amines primaires ont une température d’ébullition plus élevée que ceux secondaire et tertiaires.
A température ordinaire, seul le méthylamine est gazeux, les autres sont solides et liquides selon leurs masses moléculaires.
Les amines primaires conservent les mêmes propriétés physiques que l’ammoniac (grande solubilité, odeur d’ammoniac), les amines aromatiques sont des liquides huileux ou des solides insolubles dans l’eau et d’odeur désagréable.
5. Propriétés chimiques des amines.
Les propriétés chimiques caractéristiques des amines sont dues à la présence sur l’atome d’azote d’un doublet d’électron non liant, ce qui leur donne un caractère nucléophile (riche en électron) et basique.
5.1 Caractère basique.
En présence d’eau, les amines se comportent comme des bases de Bronsted, cet-à-dire qu’elles fixent un proton en donnant un ion substitué ammonium.
\(R - \) \(\mathop N\limits^ - {H_2} + \) \({H_2}O\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(R - \) \(NH_3^ + + \) \(O{H^ - }\)
\(R - \mathop N\limits^ - H\) \( - R' + \) \({H_2}O\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(R - NH_2^ + \) \( - R' + \) \(O{H^ - }\) En présence d’acide le proton se fixe sur l’atome d’azote.
En présence d’acide le proton se fixe sur l’atome d’azote.
\(R - N{H_2}\) \( + HCl\) \( \to \) \(R - \) \(NH_3^ + \) \( + C{l^ - }\)
5.2 Caractère nucléophile : Réaction avec les dérivés halogénés.
Les dérivés halogénés sont des composés de formule générale Ar-X, R-X ou X est un atome d’halogène (Cl, Br, I, F).
• Action de l’iodoéthane sur la triéthylamine.
Mélangeons dans un bécher des volumes égaux de triéthylamine et d’iodoéthane, en utilisant comme solvant l’éthanol, puis refroidissons ensuite dans un mélange d’eau et de glace. On obtient des cristaux qui sont ceux d’ion tétraéthylammonium.
Interprétation :
La liaison entre le carbone et l’iode dans l’iodoéthane est polarisée à cause de la forte électronégativité de l’iode par rapport au carbone. Le doublet d’électron non liant de l’azote est un cite riche en électrons cet-à-dire qu’ils peuvent se lier à des cites pauvres en électrons (cites électrophiles) :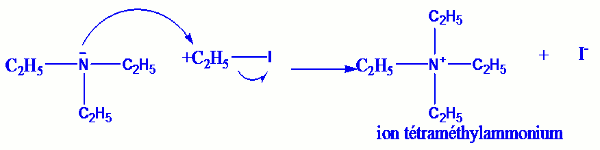 Cas généraux : Réaction d’Hoffmann.
Cas généraux : Réaction d’Hoffmann.
- Dans le cas des amines primaires, on obtient un sel d’ammonium substitué.
\(R - \) \(N{H_2} + \) \(R' - X\) \( \to \) \(R - \) \(NH_2^ + - \) \(R' + \) \({X^ - }\)
L’ion positif obtenu est acide cet-à-dire qu’il peut libérer un proton, il réagit donc avec une autre amine pour donner une amine secondaire.
\(R - NH_2^ + \) \( - R'\) \( + R - \) \(N{H_2}\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(R - \) \(NH - \) \(R' + \) \(R - \) \(NH_3^ + \)
- Dans le cas d’une amine secondaire.
\({R_1} - \) \(NH - \) \({R_2} + \) \(R - \) \(X\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \(R - \) \((RN{H^ + })\) \( - {R_2}\) \( + {X^ - }\)
- Pour les amines tertiaires on obtient un sel d’ammonium quaternaire.
\({R_1} - \) \(({R_3}NH)\) \( - {R_2}\) \( + {R_4}\) \( - X\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} \) \({R_1} - \) \(({R_3}N{R_4})\) \( - {R_2}\) \( + {X^ - }\)
Ces réactions qui permettent de passer d’une amine à une autre de clase supérieure par l’action d’un dérivé halogéné sont appelé réaction d’Hoffmann.
L’action d’un dérivé halogéné sur une amine met en évidence le caractère nucléophile des amines.
L’on peut obtenir des amides N-substitués par action des amines sur des dérivés d’acides.
Exemple :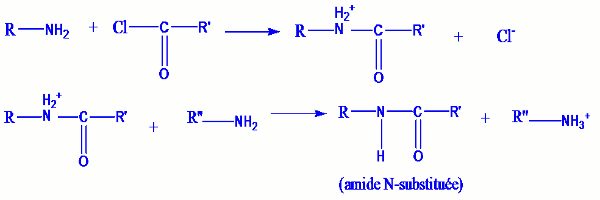 Remarque :
Remarque :
Lorsque les groupes carbonés sont des groupes alkyles (R), les amines sont dites aliphatiques, si au moins un des groupes liés à l’azote est un groupe aromatique ou (Ar) elles sont dites aromatiques.

