Objectif
Introduire l’oxydoréduction comme transfert d’électrons.
I. Notion de solution
Une solution est un mélange homogène constitué d’un solvant (en grande quantité ) et d’un soluté ( en faible quantité)
Si le solvant est l’eau, on parlera de solution aqueuse.
Une solution ionique est une solution qui conduit le courant électrique, elle est constituée des anions et des cations.
Dans l’eau pure, la concentration d’ions H3O+ est égale à celle de OH-
\(\left[ {{H_3}{O^ + }} \right] = \left[ {O{H^ - }} \right]\)
Une solution sera dite acide si elle contient plus d’ions H3O+ que dans l’eau pure.
II. Action d’un acide sur un métal
Considérons cinq tubes à essais dans lesquels on a introduit respectivement de la :
- Grenaille de zinc (tube a)
- Limaille de fer (tube b )
- Poudre d’aluminium ( tube )
- Tournure de cuivre ( tube d )
- Un fil d’argent ( tube e )
Ajoutons dans chaque tube quelque millilitre d’acide chlorhydrique (HCl)
II.1 Observation
Dans les tubes (a), (b) et ( c ), on observe un dégagement de gaz qui détonne à l’approche d’une flamme : c’est du dihydrogène.
En prélevant un peu de solution dans chaque tube (a ), (b) et ( c ) et en ajoutant une quantité suffisante d’un solution d’hydroxyde de sodium (NaOH) dans chaque prélèvement, il apparaît :
a - Dans le prélèvement du tube ( a) un précipité blanc d’hydroxyde de zinc (Zn(OH)2) qui disparaît dans un excès d’hydroxyde de sodium et dans l’ammoniac. Sa formation met en évidence la présence des ions Zn2+ en solution.
b – Dans le prélèvement du tube ( b ), un précipité vert hydroxyde de fer II (Fe(OH)2) preuve de la présence d’ions Fe2+ en solution
c - Dans le prélèvement du tube ( c ), un précipité blanc hydroxyde d’aluminium (Al(OH)3) insoluble dans l’ammoniaque (NH4OH), preuve de la présence d’ions Al3+ en solution.
e - Dans les tubes ( d ) et ( e ), il n’apparaît rien : l’acide chlorhydrique n’ a pas d’action sur le cuivre et l’argent. Nous allons donner une explication dans le chapitre suivant.
II.2. Interprétation
Dans les tubes (a), (b) et ( c), les métaux ont cédé deux ou trois électrons, ils se sont oxydés en ions métalliques et les ions H3O+ ont capté ces électrons cédés par les métaux, ils se sont réduit en donnant du dihydrogène.
Il y a eu alors transfert d’électrons entre les différents métaux et les ions. Les équations de réaction sont les suivantes :
Tube ( a )
\(Zn \to Z{n^{2 + }} + 2{e^ - }\)
\(2{H_3}{O^ + } + 2{e^ - }\) \( \to 2{H_2}O + {H_2}\)
Équation bilan
\(Zn + 2{H_3}{O^ + }\) \( \to 2{H_2}O + Z{n^{2 + }}\) \( + {H_2}\)
Tube ( b )
\(Fe \to F{e^{2 + }} + 2{e^ - }\)
\(2{H_3}{O^ + } + 2{e^ - }\) \( \to 2{H_2}O + {H_2}\)
Équation bilan
\(2{H_3}{O^ + } + Fe\) \( \to 2{H_2}O + F{e^{2 + }}\) \( + {H_2}\)
Tube ( c )
\(Al \to A{l^{3 + }} + 3{e^ - }\)
\(2{H_3}{O^ + } + 2{e^ - }\) \( \to 2{H_2}O + {H_2}\)
Équation bilan
\(6{H_3}{O^ + } + 2Al\) \( \to 6{H_2}O + 2A{l^{3 + }}\) \( + 3{H_2}\)
III. Réaction entre un métal et un ion métallique
III.1 Observation
Versons dans un bécher contenant une solution de sulfate de cuivre II ( couleur bleu ), la poudre de zinc, on observe une atténuation progressive de la couleur bleue caractéristique de la présence de l’ion Cu2+ , jusqu’à une décoloration totale du milieu réactionnel ( bécher ). Après décantation , on peut observer au fond du bécher un dépôt de couleur rouge sombre caractéristique du cuivre métal Cu.
Ajoutons quelques gouttes d’une solution diluée d’hydroxyde de soude dans la solution incolore filtrée au préalable, il apparaît un précipité blanc qui disparaît dans un excès de soude. Il s’agit d’un précipité blanc d’hydroxyde de zinc (Zn(OH)2) qui disparait dans un excès de soude, preuve que les ions Zn2+ sont présents dans la solution incolore
III.2 Interprétation
Les ions cuivre Cu2+ proviennent de la dissociation de CuSO4 en solution suivant l’équation
\(CuS{O_4} \to C{u^{2 + }} + SO_4^{2 - }\)
Le zinc a réagi avec les ions Cu2+
Le dépôt de cuivre II métal est apparu,
Les ions Zn2+ sont également présents dans le milieu réactionnel
Les atomes de Zn ont cédés (oxydés ) deux électrons suivant l’équation
\(Zn \to Z{n^{2 + }} + 2{e^ - }\)
Les ions Cu2+ en solution ont captés ( réduit ) les deux électrons cédés par le Zn suivant l’équation
\(C{u^{2 + }} + 2{e^ - } \to Cu\)
L’équation bilan devient alors :
\(C{u^{2 + }} + Zn \to Z{n^{2 + }} + \mathop {Cu}\limits_\angle \)
Zn a été oxydé en ion Zn2+ , il a subi une oxydation
Cu2+ a été réduit en Cu, il a subit une réduction
La réaction chimique au cours de laquelle il y a oxydation et réduction est appelée réaction d’oxydoréduction
III. La réaction d’oxydoréduction
Une oxydation est une réaction au cours de laquelle une espèce chimique perd ( cède ) des électrons.
Oxydation : Perte d’électrons
Une réduction est réaction chimique au cours de laquelle une espèce chimique gagne ( capte ) des électrons
Réduction : Gain d’électrons
Un oxydant est un corps simple, un composé ou un ion qui reçoit au moins un électron d'une autre espèce chimique lors d'une réaction d'oxydoréduction.
Un réducteur est un corps simple, un composé ou un ion qui cède au moins un électron à une autre espèce chimique lors d'une réaction d'oxydoréduction.
Une réaction d’oxydoréduction est une réaction au cours de laquelle il y a simultanément oxydation du réducteur et réduction de l’oxydant.
Elle consiste en un transfert d’électrons entre un oxydant d’un couple et un réducteur d’un autre couple
L’équation générale d’une réaction d’oxydoréduction est la suivante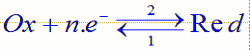 L’oxydant et le réducteur intervenant dans une réaction d’oxydoréduction sont dits conjugués et forment un couple d’oxydoréduction Ox/Red ou couple redox
L’oxydant et le réducteur intervenant dans une réaction d’oxydoréduction sont dits conjugués et forment un couple d’oxydoréduction Ox/Red ou couple redox
NB : La double flèche traduit le fait que l’échange d’électrons peut se faire dans les deux sens.
Méthode pour écrire les demi-équations électroniques :
1. Écrire la demi-équation 2. Équilibrer tous les atomes autres que O et H.
2. Équilibrer tous les atomes autres que O et H.
3. Équilibrer les O en ajoutant des molécules d’eau.
4. Équilibrer les H en ajoutant des protons H+.
5. Compléter le nombre d’électrons pour respecter les charges électriques.
Méthode pour écrire les réactions d’oxydoréduction :
1. On écrit les deux demi équations :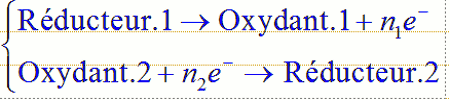 2. On s’arrange pour avoir le même nombre d’électrons transférés dans les deux équations, pour cela :On multiplie par n2 la première et par n1 la seconde :
2. On s’arrange pour avoir le même nombre d’électrons transférés dans les deux équations, pour cela :On multiplie par n2 la première et par n1 la seconde :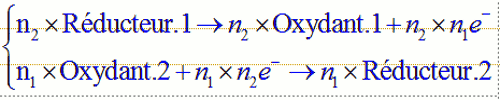 3. On additionne alors les deux demi équations, les électrons n’apparaissent plus :
3. On additionne alors les deux demi équations, les électrons n’apparaissent plus :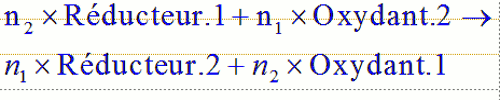 Méthode pour reconnaître l’oxydant ou le réducteur
Méthode pour reconnaître l’oxydant ou le réducteur
L’oxydant se trouve du côté des électrons.
Le réducteur est donc de l’autre côté de la flèche.


