Objectif :
Montrer la spécificité du noyau benzénique qui confère à la molécule des propriétés chimiques de molécules saturées et insaturées.
La notion d’aromaticité a longtemps été associée au caractère odorant des molécules; Depuis, cette notion a évolué pour être maintenant basée sur la structure électronique des molécules, même si la définition complète reste très complexe.
Un composé est dit conjugué lorsqu’il y’ a alternance régulière dans sa structure, de liaisons simples et multiples.
Exemple CH2=CH-CH=CH-CH2
Règle de Hückel
Une molécule est dite aromatique, lorsqu’elle :
- Possède une structure plane, cyclique et 4N + 2 électrons délocalisées (N un nombre entier )
- Est insaturée et entièrement conjuguée .
En première approximation, un composée aromatique est un composé cycliques possédant des doubles liaisons C=C en alternance régulière avec des liaisons simples C-C.
I Structure de la molécule de benzène
I-1 Structure géométrie de la molécule
Le composé aromatique le plus simple de formule brute C6H6 est le benzène.
Les 6 atomes de carbone occupent les sommets d'un hexagone régulier. Les longueurs de liaison entre atomes de carbone sont toutes égales à 140 pm, intermédiaire entre une liaison simple (154 pm) et une liaison double (134 pm).
Les liaisons C-H ont une longueur de 110 pm
Les 6 atomes d'hydrogène sont dans le même plan que les 6 atomes de carbone.
La molécule de benzène est dont plane.
Les angles valenciens sont tous égaux à 1200
I-2 Structure électronique de la molécule
Chaque atome de carbone est lié à ses trois voisins par des liaisons de covalence simple, il lui reste un électron célibataire, dont six pour l’ensemble de la molécule non-engagés dans des liaisons. Ils sont dits délocalisées
Les 6 électrons non engagés dans les liaisons simples forment un nuage électronique uniformément répartie sur l’ensemble du cycle carboné. Ils constituent ainsi une seule liaison "collective" entre les 6 atomes de carbone. La délocalisation électronique des électrons est schématisée par un cercle à l'intérieur du cycle.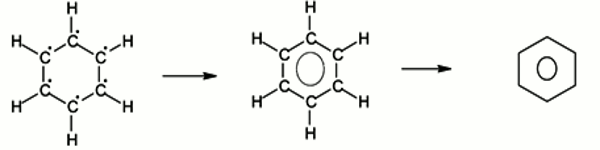
II Quelques exemples de composés aromatiques
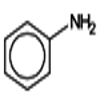
1) \({C_6}{H_5} - N{H_2}\)
Aniline
Applications
Synthèses d’une classe importante de matières plastiques,
Fabrication de colorants, de médicaments (sulfanilamide), explosives et de nombreux produits chimiques de synthèses.
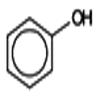
2 ) \({C_6}{H_5} - OH\)
Phénol
Applications
Utilise dans la synthèse de la résine, des matières plastiques, des insecticides, des explosifs, des colorants, des détergents et comme matière première dans la production des médicamentes tels que l’aspirine.
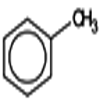
3) \({C_6}{H_5} - C{H_3}\)
Toluène
Applications
Le toluène est très utilisé comme solvant, il remplace en général le benzène, mais beaucoup plus toxique
4 ) \({C_6}{H_5} - {(C{H_3})_2}\)
Xylène
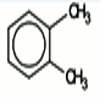
Orthoxylène ou 1,2 diméthylbenzène
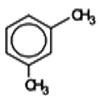
Métaxylène ou 1,3 diméthylbenzène
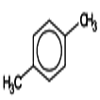
Paraxylène ou 1,4 diméthylbenzène
Applications
Utilisé dans les colorants, médicaments, les explosifs, les aromes alimentaires, les parfums, les peintures, les agents conservateurs, les insecticides et les résines
III. Propriétés chimiques du benzène
III-1. La réaction de combustion
Le benzène est un hydrocarbure, sa combustion dans le dioxygène de l’air produit du dioxyde de carbone CO2 et de l’eau H2O suivant l’équation :
\({C_6}{H_6} + \frac{{15}}{2}{O_2}\) \( \to 6C{O_2} + 3{H_2}O\)
III-2 Réaction d’addition
C’est une réaction au cours de la quelle il y a fixation d’atomes monovalents au niveau des liaisons insaturées.
III-2-1 Hydrogénation
L'hydrogénation du benzène s'effectue en bloc et conduit au cyclohexane.
Elle nécessite des conditions expérimentales ( catalyseur: nickel divisée, température :2500C, pression : 40 bars ) assez vigoureuses et un catalyseur.
\({C_6}{H_6} + 3{H_2}\) \(\xrightarrow{cataliseurs}\) \({C_6}{H_{12}}\)
III-2-2 Addition de dichlore
L'addition du dichlore sur le benzène se fait en présence des rayonnements UV ( lumière ). On obtient différents stéréo-isomères. Le 1,2,3,4,5,6-hexachlorocyclohexane de formule C6H6Cℓ6 .
\({C_6}{H_6} + 3C{l_2}\) \(\xrightarrow{lumière}\) \({C_6}{H_6}C{l_6}\)
Le 1,2,3,4,5,6-hexachlorocyclohexane est un puissant insecticide.
III-3. Réaction de substitution
La réaction consiste en la substitution d'un atome d'hydrogène du benzène.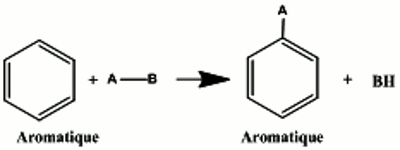 Un hydrogène ( H ) du benzène est remplacé par un électrophile A
Un hydrogène ( H ) du benzène est remplacé par un électrophile A
III-3-1 L’halogénation
III 3-1-1 La chloration
Afin d’éviter une réaction d’addition, opérons à l’abri de la lumière. En présence d’un catalyseur, le chlorure d’aluminium, AlCl3, ( d’autres acides de Lewis sont également employés : FeCl3; ZnCl2...) le dichlore réagit avec le benzène suivant une l’équation:
• Lorsque le dichlore n’est pas en excès, on obtient une monosubstitution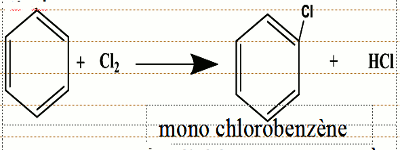 • Lorsque le dichlore est en excès et que la réaction se poursuit, on obtient une di, tri, tétra, penta puis une hexasubstitution.
• Lorsque le dichlore est en excès et que la réaction se poursuit, on obtient une di, tri, tétra, penta puis une hexasubstitution.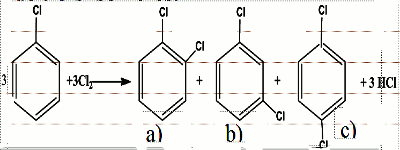 La chloration fournit un mélange de trois isomères.
La chloration fournit un mélange de trois isomères.
a) 1,2-dichlorobenzène ou orthodichlorobenzène
b) 1,3-dichlorobenzène ou métadichlorobenzène
c) 1,4- dichlorobenzene ou paradichlorobenzène
III 3-1-1 La bromation
Elle n’est pas différente de la chloration
III-3-2 Nitration du benzène
Versons goutte à goutte, du benzène dans un ballon à fond rond contenant quelques cm3 d’acide nitrique ( HNO3 ) fumant (concentré) maintenu dans de l’eau glacée. Agitons le mélange après chaque addition de benzène; jusqu'à ce que la coloration brun-rouge qui apparait ait disparu. La réaction dégage de la chaleur. Nous maintenons la température du milieu réactionnel en dessous de 60°C. Ensuite versons le mélange dans de l’eau froide.
Nous observons deux phases liquides distinctes :
• La phase aqueuse supérieure contient l’acide nitrique n’ayant pas réagi.
• La phase inférieure est formée de mononitrobenzène C6H5NO2. C’est un composé huileux, jaune claire, ayant une odeur caractéristique (odeur de colle blanche) 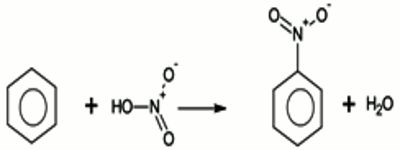 Au cours de cette réaction, on a la substitution d’un atome d’hydrogène du benzène par un groupement nitro –NO2.
Au cours de cette réaction, on a la substitution d’un atome d’hydrogène du benzène par un groupement nitro –NO2.
\({C_6}{H_6} + HN{O_3}\) \( \to {C_6}{H_5} - N{O_2}\) \( + {H_2}O\)
II-3-3 Sulfonation du benzène
L’action de l’acide sulfurique concentré sur le benzène conduit à la formation du benzène monosulfoné selon l’équation bilan de la réaction suivante :
\({C_6}{H_6} + {H_2}S{O_4}\) \( \to {C_6}{H_5} - S{O_3}H\) \( + {H_2}O\)
III-3-4 Alkylation du benzène ou réaction de Friedel et Crafts
C’est une réaction chimique catalysée par un acide de Lewis ( AlCl3, FeCl3; ZnCl2...)), d'un halogénure d'alkyle R-X, et d'un composé aromatique.
Conclusion
Une réaction de substitution sur le benzène consiste à remplacer un atome d’hydrogène par un atome ou un groupe d’atome, tout en conservant le noyau benzénique.
Les réactions de substitution sont faciles et variées : nitration, sulfonation, halogénation.
IV - Notion de rendement
Le rendement est une notion très importante en chimie, il détermine le rapport du nombre de moles obtenues par le nombre de moles théoriques.
C’est aussi le rapport de la masse du produit obtenu par la masse de produit théorique.
r = nombre de moles obtenues sur nombre de moles théorique
r = masse du produit obtenu sur masse de produit théorique
Exemple : soit la synthèse du bromobutane suivante :
\({C_4}{H_{10}}O + HBr\) \( \to \) \({C_4}{H_9}Br + {H_2}O\)
\({C_4}{H_{10}}O\left\{ \begin{array}{l}{m_1} = 1,25g\\{M_1} = 74g/mol\end{array} \right.\), \(HBr\left\{ \begin{array}{l}{m_2} = 2g\\{M_2} = 81g/mol\end{array} \right.\), \({C_4}{H_9}Br\left\{ \begin{array}{l}{m_3} = 1,6g\\{M_3} = 137g/mol\end{array} \right.\)
\[{n_{HBr}} = \frac{{{m_2}}}{{{M_2}}} = \frac{2}{{81}} = 0,025\]
D’après l’équation de réaction, il faut que 1 mole de C4H10O réagisse avec 1 mole de HBr : On dit que les deux réactifs réagissent mole à mole.
\({n_{{C_4}{H_{10}}O}} \prec {n_{HBr}}\)
Alors C4H10O est limitant
Etape 2 Calcule du nombre de mole du produit C4H9Br
On doit toujours utiliser le nombre de mole du réactif limitant pour calculer la masse du produit formé.
D’après l’équation de réaction
\({n_{{C_4}{H_{10}}O}} = {n_{{C_4}{H_9}Br}}\) soit \(\frac{{{m_1}}}{{{M_1}}} = \frac{{m{'_3}}}{{{M_3}}}\)\( \Rightarrow \) \(m{'_3} = \frac{{{m_1}}}{{{M_1}}}.{M_3}\)
Étape 3 : Calcule du rendement
\[r = \frac{{m{'_3}}}{{{m_3}}} = \frac{{1,6}}{{2,33}}100 = 69\% \]

