Exercice I Chimie organique / 6 pts
1. QCM : 1.d 0,5 pt
2.1 A et B peuvent appartenir à la famille des aldéhydes et des cétones 0,25 x 2 = 0,5 pt
2.2 Formules semi-développées de A et B et noms : 1 pt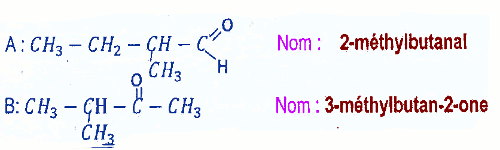 2.3.1 Équation bilan de la réaction 1 pt
2.3.1 Équation bilan de la réaction 1 pt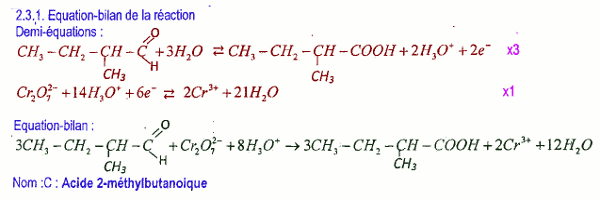
2.3.2 Formule semi-développée de C1 2.3.3.3 Deux caractéristiques de la réaction :
2.3.3.3 Deux caractéristiques de la réaction :
• Rapide
• Totale.
3.1 Une oxydation ménagée est une réaction d’oxydation au cours de laquelle le squelette carbone de la molécule n’est pas réduit 0,5 pt
3.2 Formule de B1 et B2 0.,25 x 2 = 0,5 pt
B.1 : \(\begin{array}{*{20}{c}}{}&{OH}&{}&{C{H_3}}&{}\\{}&|&{}&|&{}\\{C{H_3} - }&{CH}& - &{CH}&{ - C{H_3}}\end{array}\)
B2 : \(\begin{array}{*{20}{c}}{}&{}&{C{H_3}}&{}&{}\\{}&{}&|&{}&{}\\{CH = }&{CH - }&{CH}& - &{C{H_3}}\end{array}\)
Exercice II Acides et bases / 6 pts
1.1. c) Le plus petit pKa 0,5 pt
1.2. c) La phénolphtaléine 0,5 pt
2.1 pH d’une solution neutre à 37 oC
Soit \(p{H_N}\) le pH d’une solution neutre : \(p{H_N} = \frac{1}{2}pKe\) \( = - \frac{1}{2}\log Ke\) 0,5 pt
A.N : \(p{H_N} = 6,81\) 0,25 pt
2.2 Cette salive est basique car son pH (6,90) est supérieur à celui d’une solution neutre (6,81) à 37 oC 0,5 pt + 0,25 pt = 0,75 pt
2.3 Concentration des ions \(H{O^ - }\) : \(Ke = \left[ {H{O^ - }} \right].\left[ {{H_3}{O^ + }} \right]\) d’où
\(\left[ {H{O^ - }} \right] = \) \(\frac{{Ke}}{{\left[ {{H_3}{O^ + }} \right]}} = \) \(\frac{{Ke}}{{{{10}^{ - pH}}}}\) 0,25pt
A.N : \(\left[ {H{O^ - }} \right] = \) \(2,4 \times {10^{ - 9}}\) mol/L 0,25 pt
3.1 Montrons que \(N{H_3}\) est une base
Il suffit de montrer que dans la solution de \(N{H_3}\), on a \(\left[ {H{O^ - }} \right] \prec Cb\)
\(\left[ {H{O^ - }} \right] = \) \(\frac{{Ke}}{{{{10}^{ - pH}}}} = \) \(\frac{{{{10}^{ - 14}}}}{{{{10}^{ - 10,6}}}} = \) \(3,98 \times {10^{ - 4}}\) mol/L or \(Cb = {10^{ - 2}}\) mol/L 0,25 pt
Donc \(N{H_3}\) est une base faible 0,25pt
3.2 Équation bilan de la réaction avec l’eau
\(N{H_3} + {H_2}O\) \( \to \) \(NH_4^ + + H{O^ - }\) 0,5 pt
4.1 Équation bilan de la réaction
\(N{H_3} + \) \({H_3}{O^ + } \to \) \(NH_4^ + + {H_2}O\) 0,5 pt
4.2 Calcul de VA et VB
Comme \(pH = p{K_A}\), alors le mélange est réalisée à la demi-équivalence
Ainsi, \(\frac{{{n_B}}}{2} = {n_A}\) \( \Rightarrow {C_B}{V_B}\) \( = 2{C_A}{V_A}\) avec \({C_A} = {C_B}\), nous avons \({V_B} = 2{V_A}\). En plus \({V_B} = 2{V_A}\), il revient donc de résoudre ce système d’équation
\(\left\{ \begin{array}{l}2{V_A} - {V_B} = 0\\{V_A} + {V_B} = V\end{array} \right.\) 0,5 pt
Soit : \({V_A} = 38,6\) mL et \({V_B} = 77,33\) mL 0,5 pt
4.3 la solution tampons permet : 0,5 pt
• D’étalonner les pH-mètres ;
• De fabriquer des médicaments afin d’éviter les variations de pH.
Exercice III Chimie générale / 4pts
1. Un facteur cinétique : 0,5pt +0,25 pt = 0,75 pt
Le catalyseur : il augmente la vitesse d'une réaction d'une réaction lente
La température : la vitesse de formation ou de disparition d'une espèce augmente avec la température
La concentration initiale des réactifs : la vitesse de formation ou de disparition d'une espèce augmente avec la concentration initiale des réactifs
2.1 On dit que les énergies sont quantifiés parce qu'ils ne peuvent prendre que certaines valeurs bien déterminées.
2.2. Énergie au premier état excité (n = 2) : \({E_2} = - \frac{{13,6}}{{{2^2}}}\) \( = - 3,4\) eV soit \({E_2} = \) \( - 5,44 \times {10^{ - 19}}J\) 0,5pt
2.3.1. Il y a absorption car l’atome passe d'un niveau d'énergie inférieur vers un niveau d’énergie supérieur (passage de n=l à n = 2 ) 0,25 pt x 2 = 0,5 pt
2.3.2. Fréquence N de la radiation émise
\({E_3} - {E_1} = \) \(hN \Rightarrow \) \( - \frac{{{E_0}}}{9} + \frac{{{E_0}}}{1}\) \( = hN\) soit \(N = \frac{{8{E_0}}}{{9h}}\) 0,25 pt + 0,5 pt = 075 pt
- 2.4. Calcul de la plus grande longueur d'onde \({\lambda _{\max }}\).
Elle correspond à la transition du niveau n = 1 au niveau n = 2. 0,25 pt
\({E_2} - {E_1}\) \( = \frac{{hC}}{{{\lambda _{\max }}}}\) \( \Rightarrow {\lambda _{\max }}\) \( = \frac{{4hC}}{{3{E_0}}}\)
\({\lambda _{\max }} = \) \(1,22 \times {10^{ - 7}}\) m 0,5 pt
Exercice IV Expérimental / 4 pts
1. Schéma du dispositif 1 pt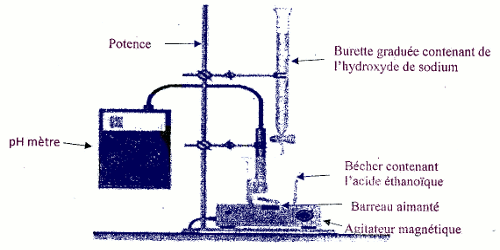 2. Traçons la courbe \(pH = f({V_B})\) 1pt
2. Traçons la courbe \(pH = f({V_B})\) 1pt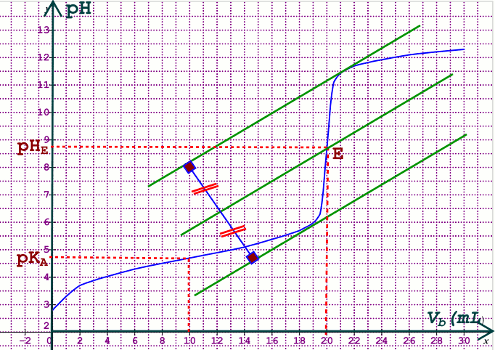 3.1 Coordonnées du point d’équivalence E : En appliquant la méthode des tangentes parallèles, on trouve : 0,5 pt x 2= 1 pt
3.1 Coordonnées du point d’équivalence E : En appliquant la méthode des tangentes parallèles, on trouve : 0,5 pt x 2= 1 pt
\(E\left( \begin{array}{l}{V_{{b_E}}} = 20mL\\p{H_E} = 8,7\end{array} \right)\)
3.2 pKA du couple \(C{H_3}COOH/\) \(C{H_3}CO{O^ - }\)
Le pKA et le pH du milieu réactionnel à la demi-équivalence, c’est à dire lorsque \({V_b} = \frac{{{V_{{b_E}}}}}{2}\) = 10 mL
Graphiquement, nous trouvons \(p{K_A} = 4,7\) 0,5 pt
3. Calcule de CA
A l’équivalence, \({C_a}{V_a} = {C_b}{V_{{b_E}}}\) \( \Rightarrow Ca = \) \(\frac{{{C_b}{V_{{b_E}}}}}{{{V_a}}} = 0,1\) mol/L 0,25 pt x 2 = 0,5 pt

