Partie : Évaluation des ressources / 24 points
Exercice I : Vérification des savoirs / 8 pts
Définition des termes :
• Facteur cinétique : Facteur susceptible d’influencer ou de modifier la vitesse d’une réaction chimique 1 pt
• Vitesse instantanée de disparation d’un réactif : Opposée de la valeur, à la date \(t\), de la dérivée par rapport au temps de la quantité de matière au de la concentration d’un réactif..
La vitesse instantanée de disparition d’un réactif est définie par : : \(V = - {\left( {\frac{{d\left[ R \right]}}{{dt}}} \right)_t}\) ou \(V = - {\left( {\frac{{d{n_R}}}{{dt}}} \right)_t}\) avec \(R\) le réactif. 1 pt
2.) La trempe permet de stopper l’évolution de la réaction chimique 1 pt
3.) Questions à choix multiple (QCM) 1 pt
• b (augmente)
4.) Formule semi développée du 2-amino-2, 3-dimethylbutan-1-ol 1 pt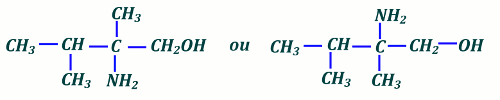 5.) Diastéréo-isomères de 4-methylpen-2-ène 2 pts
5.) Diastéréo-isomères de 4-methylpen-2-ène 2 pts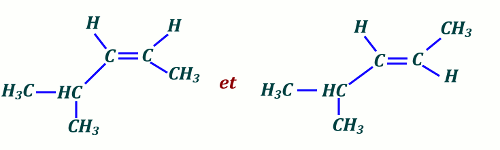 6.) Équation Bilan : 1 pts
6.) Équation Bilan : 1 pts
\(C{H_3} - N{H_2} + \) \({H_2}O \to C{H_3} - \) \(\mathop N\limits^ + {H_3} + O{H^ - }\)
Exercice 2 : Application des savoirs / 8 points
1. \(C{H_3}COOH\) est moins acide que \({C_6}{H_5} - COOH\), car le \(pKa\) \(\left( {{C_6}{H_5} - COOH/{C_6}{H_5} - CO{O^ - }} \right)\) \( \prec pKa\) \(\left( {C{H_3}COOH/C{H_3}CO{O^ - }} \right)\)
2. Forme prédominante de l’aspirine est la forme acide car le \(pH \prec pKa\) du couple acide / base de l’aspirine. 1,5 pt
3. \(Ka = \left[ {{H_3}{O^ + }} \right] \times \) \(\left[ {O{H^ - }} \right] \Rightarrow \left[ {{H_3}{O^ + }} \right] = \) \(\frac{{Ka}}{{\left[ {O{H^ - }} \right]}} = 2 \times {10^{ - 3}}\) mol/L 1, 5 pt
4.1) Formule semi-développée de Ala-Gly 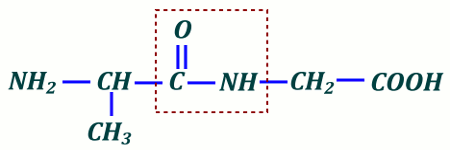 4.2 1,5 pt
4.2 1,5 pt
• Bloquer la fonction acide carboxylique de la glycine ;
• Bloquer la fonction amine de l’alanine ;
• Activer la fonction acide carboxylique de l’alanine ;
• Régénérer les fonctions bloquées après formation de la liaison peptidique.
5. Formule semi-développée de l’alcool 1,5 pt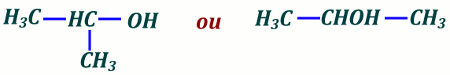
Exercice 3 : Utilisation des savoirs / 8 points
1.1 Actions à mener pour accélérer la réaction 1 pt
• Utiliser l’acide sulfurique comme catalyseur ;
• Augmenter la température.
1.2 1 pt
\({n_{ac}} = \frac{m}{M} = 0,53\) mol et \({n_{al}} = \frac{{16}}{{88}} = 0,18\) mol alors \({n_{ac}} \succ {n_{al}}\)
Le réactif en excès est l’acide sulfurique
1.3 Déterminons la masse obtenue d’ester 1, 5pt
\(r = \frac{{{m_E}(attendue)}}{{{m_E}(obtenue)}}\) \( \Rightarrow {m_E}(obtenue) = \) \(\frac{{{m_E}(attendue)}}{{100}} \times r\)
\(C{H_3} - COOH + \) \(C{H_3} - CH(C{H_3}) - \) \(C{H_2} - C{H_2} - OH\) \( \to C{H_3} - COO - \) \(C{H_2} - C{H_2} - \) \(CH(C{H_3}) - C{H_3}\) \( + {H_2}O\)
\(\frac{{{m_{al}}}}{{{M_{al}}}} = \) \(\frac{{{m_{est}}(attendue)}}{{{M_{est}}}}\) \( \Rightarrow {m_{est}}(attendue) = \) \(\frac{{{m_{al}} \times {M_{est}}}}{{{M_{al}}}}\)
\({m_{est}}(attendue) = \) \(\frac{{{m_{al}} \times {M_{est}} \times r}}{{{M_{al}} \times 100}}\) \( = 13,95\) g
1.4) On peut remplacer l’acide acétique par : le chlorure d’ethanoyle \(\left( {C{H_3} - COCl} \right)\) ou l’anhydride éthanoïque (\(C{H_3} - CO - O\) \( - CO - C{H_3}\))
Équation bilan
\(C{H_3} - COCl - \) \(C{H_3} - CH(C{H_3}) - \) \(C{H_2} - C{H_2}OH \to \) \(C{H_3} - CO - O\) \( - CO - C{H_2} - \) \(C{H_2} - CH(C{H_3}) - \) \(C{H_3} + HCl\)
Ou
\(C{H_3} - CO - O - \) \(CO - C{H_3} + C{H_3}\) \( - CH(C{H_3}) - C{H_2} - \) \(C{H_2} - OH \to \) \(C{H_3} - CO - O - \) \(CO - C{H_2} - C{H_2}\) \( - CH(C{H_3}) - C{H_3}\) \( + C{H_3}COOH\)
2.1 Le benzène joue le rôle de solvant
2.2 Équation bilan de la réaction 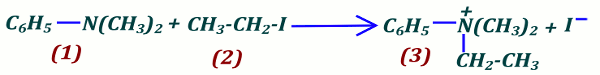 2.3
2.3
\({n_1} = {n_3} = \frac{{{m_3}}}{{{M_3}}}\) \( \Rightarrow {m_3} = {n_1} \times {M_3}\) \( = 0,2 \times 276,9 = \) \(55,38\) g
Partie B : Évaluation des ressources / 16 pts
Tâche 1 : 1ere méthode
Préparation d’une solution d’acide chlorhydrique de \(pH = 4\) a partir d’une solution mère de \(pH = 3\)
Déterminons le volume \({V_0}\)de la solution à prélever :
• Lors de la dilution
\({n_0} = {n_f} \Leftrightarrow \) \({C_0}{V_0} = {C_f}{V_f}\)
\({C_0} = \left[ {{H_3}{O^ + }} \right] = \) \({10^{ - pH}} = {10^{ - 3}}\) mol/L
\({C_f} = \left[ {{H_3}{O^ + }} \right] = \) \({10^{ - pH}} = {10^{ - 4}}\) mol/L
\({V_0} = \frac{{{C_f}{V_f}}}{{{C_d}}}\) \( = 20\) Ml
Protocole : on effectue une dilution
A l’aide d’une pipète jaugée de 20mL, prélever 20mL de la solution \(S_0\) et l’introduire dans une fiole jaugée de 200 mL contenant au préalable de l’eau distille. Compléter ensuite la solution obtenue avec l’eau distille jusqu’au trait de jauge tout en homogénéisant.
Tâche 1 : 2ieme méthode
On effectue la dilution
\(p{H_0} = p{H_f} + 1\)
Il s’agit d’une dilution au dixième car l’acide chlorhydrique est un acide fort
\({C_f} = \frac{{{C_0}}}{{10}} = 20\) mL
Protocole : on effectue une dilution
A l’aide d’une pipète jaugée de 20mL, prélever 20mL de la solution \(S_0\) et l’introduire dans une fiole jaugée de 200 mL contenant au préalable de l’eau distille. Compléter ensuite la solution obtenue avec l’eau distille jusqu’au trait de jauge tout en homogénéisant.
Tâche 2
Déterminons le nombre maximum de cuillerées de 7,5mL à prendre par jour pour un malade.
• Équation de la réaction
\(Mg{(OH)_2} + 2({H_3}{O^ + }\) \( + C{l^ - }) \to MgC{l_2} + \) \( 4{H_2}O\)
• Déterminer la quantité de nattière de \(Mg{(OH)_2}\) nécessaire pour neutraliser les ions \({H_3}{O^ + }\) présents dans le suc gastrique en 24 h
En effectuant un bilan molaire, on a :
\(\frac{{{n_{Mg{{(OH)}_2}}}}}{1} = \frac{{{n_{{H_3}{O^ + }}}}}{2}\) \( \Rightarrow {m_{Mg{{(OH)}_2}}} = \) \(\frac{{\left[ {{H_3}O} \right].{V_{Mg{{(OH)}_2}}}}}{2}\) \( = 0,583\) g
• Déterminons le volume de la suspension correspondant à 0,583g de \(Mg{(OH)_2}\)
250Ml de solution contient 9,75 g d’hydroxyde de magnésium
Pour une masse de 0,583 g, le volume correspondant sera de 15 g ( règle de trois)
• Déterminons le nombre de cuillerées de 7,5mL a prendre pour le traitement.
La contenance d’une cuillerée étant de 7,5mL, nous obtiendrons 2 cuillerées ( règle de trois).
Conclusion : pour son traitement, le malade doit consommer 2 cuillerées de 7,5 mL par jour.

