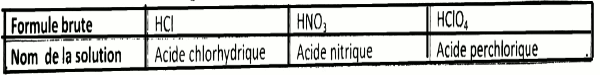
Partie A : Évaluation des ressources / 24 points
Exercice l : Vérification des savoirs / 8 points
l- Définir : Dibase forte: liaison peptidique. 2 pts
2- Donner deux caractéristiques de la réaction entre un acide fort et une base faible. 1 pt
3- Réponde par vrai ou faux :
3-l Une base faible est d'autant plus forte que la constante d'acidité (Ka) du couple auquel elle appartient est plus petit. 1 pt
3-2 Lors du dosage d'un acide faible par une base forte. la demi-équivalence est définie par l'égalité entre la quantité de matière de l’acide faible (AH ou \(B{H^ + }\)) ct de sa base conjuguée (\({A^ + }\) ou B ). 1 pt
3-3- Une solution d‘acide nitrique dont le pH varie peu par dilution est appelée solution tampon. 1pt
4- Proposer une méthode chimique permettant de suivre l'évolution de la réaction entre les ions iodure et les ions pérosodisulfate. 1 pt
5- Écrire la formule générale des acides alpha-aminés 1 pt
Exercice 2 : Application des savoirs / 8 points
1. L’éthylamine (\({C_2}{H_5}N{H_2}\)) est une base faible.
Écrire la formule de son acide conjugué et dire s'il est un acide fort ou faible. 1 pt
2 Par oxydation ménagère d'un alcool secondaire A de formule brute \({C_4}{H_{10}}O\), on obtient un compose B.
2- l - Donner la formule semi-développée de B. 0,5pt
2-2 -L‘action du chlorure de propanoyle sur A, donne un composé C.
Donner la formule senti-développée et la fonction chimique de C. 1 pt
2-3- Deux autres composés organiques D et E, réagissent chacun sur A. permettent d'obtenir le compose C.
2-3-l- Donner le nom et la formule semi-développée de D et F. 1 pt
2-3-2- Écrire l’équation-bilan de chacune de ces réactions. 1 pt
3- On considère la N-éthyl-N-phénylatnine:
3-l- Donner sa nature puis écrire sa formule semi-développée. 1 pt
3-2- Cette amine réagit avec l’iodoéthane en excès.
3-2- l - Écrire les équations des réactions observées. 1,5pt
3-2-2- Nommer le composé final obtenu et dire sous quelle forme physique il se trouve. 1 pt
Exercice 3 : Utilisation des savoirs : 8 points
1. A la date t = 0. on introduit dans des tubes à essai \(2 \times {10^{ - 2}}\) mol d’éthanoate d'éthyle et \(2 \times {10^{ - 2}}\) mol d'eau. A des intervalles de temps égaux et réguliers, on plonge un tube dans un bain de glace puis on dose l’acide éthanoïque formé à l'aide d'une solution d'hydroxyde de sodium de concentration \(Cb = 1\) en présence d‘un indicateur coloré. Il faut verser un volume \(Vb\) de solution d’hydroxyde de sodium pour atteindre l'équivalence. Un groupe d'élève obtient les résultats consignés dans le tableau suivant : 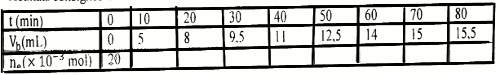 l-l Écrire l'équation-bilan de la réaction entre l’éthanoate d’éthyle et l'eau . 1 pt
l-l Écrire l'équation-bilan de la réaction entre l’éthanoate d’éthyle et l'eau . 1 pt
I-2- Montrer que le nombre de mole d’ester \({n_e}\) restant dans chaque tube à la date t est donne en mole par \({n_e} = 2 \times {10^{ - 2}}\) \( - CbVb\) 1 pt
l-3- Compléter le tableau purs tracer sur le papier millimètre la courbe \({n_e} = f(t)\) 2 pts
Échelle : 2 cm pour 10 min et 1cm pour \({10^{ - 3}}\) mol
l-4 Déterminer la vitesse instantanée de disparition de l'ester à t =20 min. 1 pt
2- On synthétise un savon à partir de la stéarine de formule \({C_{57}}{H_{110}}COONa\) et de la soude \(NaOH\).
2-1 Écrire l'équation-bilan de la réaction. 1 pt
2-2 Déterminer la masse de stéarate de sodium (savon) de formule \({C_{17}}{H_{35}}COONa\) obtenu si on a introduit dans un vase 85 kg de stéarine et 10 l de soude de concentration 5 moL/L.
Le rendement de la réaction étant 91%. 2 pts
On donne: Masses molaires : savon :306 g/mol ; C :12 ; O :16; H :l ; Na :23.
Partie B: Évaluation des compétences : / 16 points
En rangeant les solutions acides dans leurs compartiments Au laboratoire. Corine trouve un flacon douteux. Sur son étiquette, les indications suivantes sont inscrites en manuscrit :
Monoacide fort : Concentration voisine de \(8 \times {10^{ - 3}}\) mol/L.
Afin de s'assurer de la grandeur inscrite sur l’étiquette (\(8 \times {10^{ - 3}}\) mol/L) et y insérer ensuite le nom de la solution contenue dans le flacon, elle effectue les opérations suivantes :
• Dosage d'un volume V, 5 ml, de cet acide l'on note HA par une solution aqueuse d'hydroxyde de calcium (\((C{a^{2 + }} + 2H{O^ - })\)) de concentration \({C_B} = 2,2 \times {10^{ - 3}}\) mol/L.
• Déshydratation complète pur évaporation du mélange obtenu à l'équivalence.
Résultats obtenus :
Résultat 1 : courbe donnant les variations du pH en fonction du volume de base verse :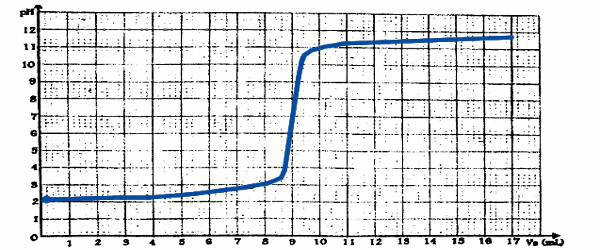 Résultat 2 : 3,248 mg d'un composé X obtenu après évaporation du mélange à l'équivalence.
Résultat 2 : 3,248 mg d'un composé X obtenu après évaporation du mélange à l'équivalence.
1 Donne ton avis sur l'indication de la concentration inscrite sur l'étiquette ; 8 pts
2- Identifie l'acide fort présent dans le flacon. 8 pts
Données: Masses molaires en g/mol : H : 1 ; Cl : 35,5 ; O : 16 ; N : 14 ; Ca :40,04.