Objectifs : à la fin de ce chapitre, l’élève sera capable de :
• Établir la relation entre l’équipement enzymatique d’une cellule et les réactions qui s’y déroulent
• Déterminer les caractéristiques de l’activité enzymatique
• Établir la relation entre la structure et la fonction de la protéine enzyme
Un catalyseur est une substance qui, à faible dose, accélère une réaction chimique et se retrouve intacte à la fin de cette réaction. Si la réaction a lieu chez un être vivant pour permettre son métabolisme, le catalyseur est appelé enzyme ; autrement dit, les enzymes sont les catalyseurs des réactions biologiques ou biocatalyseurs.
Toutes les cellules ne contiennent pas les mêmes enzymes ou tout simplement qu’à chaque cellule correspond son équipement enzymatique.
L’équipement enzymatique d’une cellule est l’expression de l’information génétique adapté en nature et en quantité aux besoins de la cellule. Il conditionne les réactions de dégradation et de synthèse qui s’y déroulent.
I. Caractéristiques de l’activité enzymatique
1) Notion d’enzyme
Une enzyme est un catalyseur biologique synthétisé par un être vivant qui, à faible dose accélère la vitesse d’une réaction biochimique.
Selon leur composition, on peut distinguer :
• Les enzymes entièrement protéiques ou holoenzymes
• Les enzymes formées d’une fraction protéique (apoenzyme) et d’une fraction non protéique(cofacteur ou coenzyme). Dans ce cas, l’activité catalytique de l’enzyme est déterminée par l’apoenzyme mais impossible en absence des coenzymes
2) Propriétés générales des enzymes
Les enzymes sont des catalyseurs biologiques différents des catalyseurs chimiques. Quelques caractéristiques différenciant ces deux groupes de catalyseurs sont :
| Eléments de comparaison | Catalyseur biologique (enzyme) | Catalyseur chimique |
| Nature du substrat | protéique | chimique |
| Lieu de synthèse | Etres vivants | laboratoire |
| Dose d’action | Faible dose | Forte dose |
| Vitesse de la réaction | Elevée | faible |
| Température efficace | Température biologique (\({37^o}\)C) | Température très élevée |
| Spécificité-de substrat | Très spécifique | Peu spécifique |
| exemples | Lactase, saccharase, protéase | \(HCl\), \({H_2}S{O_4}\) , \(NaOH\), \(pt\) |
2.1 Influence de la température sur l’activité enzymatique
Le graphe ci-dessous montre la variation de la vitesse de la réaction enzymatique de l’amylase salivaire sur l’amidon en fonction de la température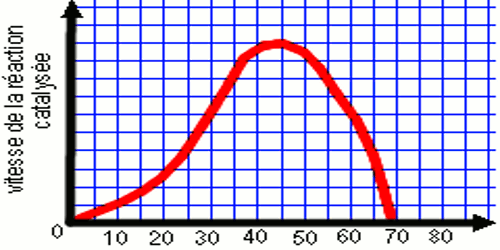 Interprétation et conclusion
Interprétation et conclusion
• A 0°C l’activité enzymatique est presque nulle. Les enzymes sont inactives à basses températures.
• La vitesse de la réaction augmente avec la température et atteint sa valeur maximale entre 37 et 40°C. L’inactivation à basses température est donc réversible lorsque la température redevient normale. 37 et 40°C représente la température optimale de l’activité enzymatique.
• A partir de 45°C, la vitesse de la réaction diminue avec la température et finie par s’annuler à 70°C. les enzymes se dénaturent à haute température. Cette dénaturation est irréversible.
2.2 Des conditions de pH spécifiques
Les expériences de digestion in vitro réalisées sur l’amidon en présence de l’amylase salivaire et sur l’ovalbumine en présence de la pepsine gastrique et de la trypsine pancréatique révèlent que chaque enzyme a une activité optimale dans des conditions de pH bien précises.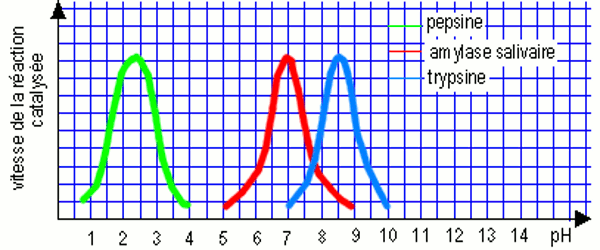 • L’amylase salivaire est active en milieu neutre (pH = 7) ; la pepsine gastrique en milieu acide (pH inférieur à 7) et la trypsine en milieu légèrement basique (pH légèrement supérieur à 7).
• L’amylase salivaire est active en milieu neutre (pH = 7) ; la pepsine gastrique en milieu acide (pH inférieur à 7) et la trypsine en milieu légèrement basique (pH légèrement supérieur à 7).
• Plus généralement, chaque enzyme possède un pH optimum d’activité.
2.3 Spécificité de substrat
Le substrat est la molécule dont l’enzyme catalyse la transformation. Une enzyme donnée ne peut agir que sur un seul substrat.
Le nom de l’enzyme est très souvent indicateur du substrat transformé.
| Enzyme | Substrat |
| Amylase Lipase Maltase Lactase Ribo-nuclease |
Amidon Lipide Maltose Lactose Acide ribonucléique |
Remarque : Sur un substrat donné, plusieurs enzymes peuvent agir ; mais chacune d’elles agit sur une partie différente de ce substrat. C’est le cas de la trypsine et de la pepsine qui agissent toutes les deux sur l’albumine.
2.4 Une spécificité d’action
Une enzyme donnée ne peut catalyser qu’un seul type de réaction. C’est ainsi qu’on distingue :
• Les hydrolases qui catalysent les réactions d’hydrolyse
• Les oxydases qui catalysent les réactions d’oxydation
• Les déshydrogénases qui catalysent les réactions de déshydrogénation
• Les décarboxylases qui catalysent les réactions de décarboxylation
2.5) Influence de la concentration du substrat sur l’activité enzymatique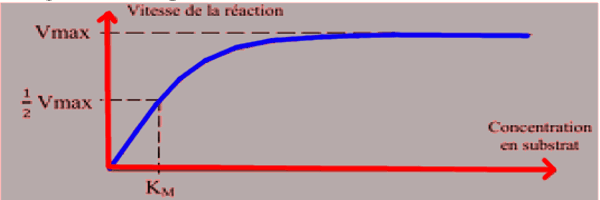 Les travaux réalisés sur la cinétique enzymatique ont permis d’obtenir la courbe des vitesses en fonction des concentrations en substrat (amidon), pour une quantité d’enzyme (amylase) fixée
Les travaux réalisés sur la cinétique enzymatique ont permis d’obtenir la courbe des vitesses en fonction des concentrations en substrat (amidon), pour une quantité d’enzyme (amylase) fixée
L’activité d’une enzyme (E) peut être évaluée par la mesure de la vitesse de la réaction catalysée. Cette mesure se fait par dosage de la quantité de produit (P) apparue en fonction du temps après transformation d’un substrat (S). Globalement une réaction enzymatique est matérialisée par l’équation
\(E + S\) \(\rightleftarrows\) \(ES \to E\) \( + P\)
La vitesse de la réaction enzymatique est nulle pour une concentration nulle en substrat. La vitesse enzymatique augmente avec la concentration en substrat et atteint une valeur maximale (Vmax) pour une concentration optimale. Au-delà de cette concentration, la vitesse de l’activité enzymatique n’augmente plus quelqu’un soit la concentration en substrat. On dit que l’enzyme est saturée.
La constante de Michaelis (KM) représente la concentration en substrat pour laquelle la vitesse de la réaction est la moitié de la vitesse maximale (Vmax).
Si KM est faible, cela signifie que l’enzyme a une forte activité
Si KM est élevée, l’enzyme a une faible activité.
II. Relation entre structure et fonction de la protéine enzyme
1) Notion de site actif
Le site d’actif d’une enzyme est une région de cette enzyme capable de fixer un substrat spécifique et de catalyser sa transformation. Ce site actif présente une étroite complémentarité avec d’autres régions du substrat telle une serrure et sa clé. La complémentarité entre le site actif de l’enzyme et une région très précise de son substrat explique la spécificité enzymatique. Le site actif possède deux zones bien définies:
• Le site de fixation qui reconnaît un substrat spécifique avec lequel il présente des affinités
• Le site catalytique constitué d’acides aminés capables d’interagir avec le substrat.
2) Notion de complexe Enzyme-Substrat
La première étape la catalyse enzymatique est la formation du complexe enzyme-substrat (ES) ; ce qui explique la structure de l’enzyme.
La dissociation du complexe ES libère le produit ce qui rend à nouveau l’enzyme disponible pour s’associer à une nouvelle molécule de substrat.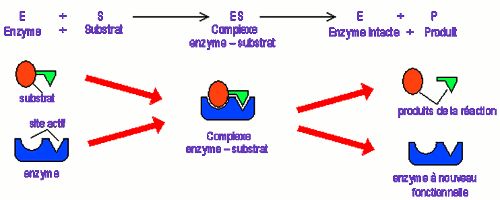 Ainsi, l’efficacité d’une enzyme dépend du temps pendant lequel l’enzyme reste associée au substrat.
Ainsi, l’efficacité d’une enzyme dépend du temps pendant lequel l’enzyme reste associée au substrat.
Conclusion
Toutes les réactions chimiques qui se produisent dans les cellules vivantes sont catalysées par des enzymes. L’équipement enzymatique d’une cellule conditionne les réactions qui s’y produisent.
Les enzymes sont des biocatalyseurs qui agissent dans certaines limites de température et de pH.
Elles sont spécifiques d’un substrat qu’elles transforment et d’un seul type de réaction.
La fonction de l’enzyme est liée à sa structure : la complémentarité entre le site actif et une zone spécifique du substrat permet la formation du complexe enzyme – substrat, étape indispensable à la catalyse de la réaction.


