Objectifs :
♣ Montrer les caractéristiques des réactions acide/base.
♣ Montrer les applications de ces réactions aux dosages et à la préparation des solutions tampons.
L’étude des réactions acide/base est très importante car elle nous permet de savoir et de comprendre de nombreuses réactions ayant lieu dans notre organisme lorsque nous consommons certains produits acides ou basiques. Elle nous permet de vérifier la composition de nombreux produits agricole ou pharmaceutique.
1. Définitions.
Le dosage est une opération qui consiste à déterminer la concentration d’une solution à partir d’une autre solution de concentration connue.
Dosage acido-basique : Opération qui consiste à déterminer la concentration d’un acide ou d’une base à l’aide d’une solution de base ou d’acide de concentration connue.
Les indicateurs colorés sont des substances dont la couleur dépend du pH du milieu.
Zone de virage : Intervalle de pH où se produit le changement de couleur de couleur de l’indicateur coloré.
Teinte sensible : Couleur de l’indicateur coloré dans sa zone de virage.
On distingue :
• Le dosage pH-métrique qui consiste à mesurer progressivement la valeur du pH d’une solution par ajout modérer de la solution titrante.
• Le dosage colorimétrique qui se fait par utilisation d’un indicateur coloré. On observe dans ce cas un changement de couleur.
Point d’équivalence : C’est le point ou le nombre de moles de base est égal au nombre de mole d’acide.
2. Réaction acide fort base forte : Cas d’une solution aqueuse d’acide chlorhydrique et d’hydroxyde de sodium.
2.1 Équation de la réaction et caractéristiques :
L’équation de la réaction entre une solution d’acide chlorhydrique (\({H_3}{O^ + } + C{l^ - }\) ) et d’hydroxyde de sodium (\(N{a^ + } + {}^ - OH\) ) s’écrit :
\(({H_3}{O^ + } + C{l^ - })\) \( + (N{a^ + }\) \( + {}^ - OH)\) \( \to \) \(2{H_2}O + \) \((N{a^ + } + C{l^ - })\)
C’est une réaction rapide, totale et exothermique.
Expérience :
Dans un volume \(Va = 100\) ml d’une solution d’acide chlorhydrique de concentration \(Ca = {10^{ - 2}}\) mol/L, contenue dans un bécher et de \(pH = 2\), versons à l’aide d’une micro-pipette un volume Vb = 1 ml d’une solution d’hydroxyde de sodium de concentration \(Cb = 0,5\) mol/L, après agitation, le pH obtenu est 2,3.
a. Les nombres de moles d’ions \({H_3}{O^ + }\) et \({}^ - OH\) avant la réaction sont :
◊ \({n_{{H_3}{O^ + }}} = \) \([{H_3}{O^ + }] \times Va\) \( = {10^{ - 3}}\) mol.
◊ \({n_{{}^ - OH}} = \) \([{}^ - OH] \times Vb\) \( = 5 \times {10^{ - 3}}\) mol.
b. Les nombres de mole d’ions \({H_3}{O^ + }\) et \({}^ - OH\) après la réaction sont:
→ \(n_{{H_3}{O^ + }}^r = \) \([{H_3}{O^ + }] \times \) \((Va + Vb)\) \( = 5 \times {10^{ - 4}}\) mol.
→ \(n_{{}^ - OH}^r = \) \([{}^ - OH] \times \) \((Vb + Va) \approx \) \([{}^ - OH]Va = \) \(Ke\frac{{Va}}{{[{H_3}{O^ + }]}}\) \( = 2 \times {10^{ - 12}}\) mol.
c. Les quantités d’ions \({{H_3}{O^ + }}\) et \({}^ - OH\) consommées et disparus respectivement sont :
♥ \(\Delta {n_{{H_3}{O^ + }}} = \) \(({n_{{H_3}{O^ + }}} - \) \(n_{{H_3}{O^ + }}^r) = \) \(5 \times {10^{ - 4}}\) mol
♥ \(\Delta {n_{{}^ - OH}} = \) \(({n_{{}^ - OH}}\) \( - n_{{}^ - OH}^r)\) \( = 5 \times {10^{ - 4}}\) mol
Conclusion.
Les ions hydroniums ou oxoniums \({H_3}{O^ + }\) en excès dans le mélange ont donc réagit avec la quasi-totalité d’ions hydroxydes \({}^ - OH\).
La réaction de transfert prépondérante qui a lieu est donc :
\({H_3}{O^ + }\) \( + {}^ - OH\) \( \to 2{H_2}O\)
C’est une réaction chimique exothermique. Les ions \(C{l^ - }\) et \(N{a^ + }\) ne participent pas au transfert de proton, ils sont dits spectateurs ou indifférents. Si on évapore toute l’eau dans la solution, il se forme des cristaux blancs de NaCl.
Généralisation
De manière générale, la réaction entre un acide fort et une base forte est celle entre les ions \({H_3}{O^ + }\) apportés par la solution acide et \({}^ - OH\) apportés par la solution basique tel que :
\({H_3}{O^ + }\) \( + {}^ - OH\) \( \to \) \(2{H_2}O\)
2.2 Dispositif expérimental.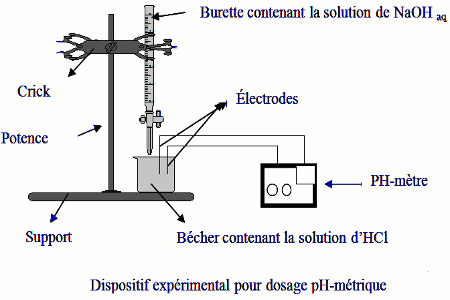 2.3 Courbe de pH
2.3 Courbe de pH
a) Tracé de la courbe \(pH = f(Vb)\)
Le dispositif ci-dessus permet, pour chaque volume de base versé de connaître la valeur du pH de la solution. On a obtenu expérimentalement les résultats ci-dessous :
| pH | 2 | 2,1 | 2,2 | 2,3 | 2,4 | 2,5 | 2,6 | 2,7 | 2,9 | 3,3 |
| Vb (mL) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 3,6 | 4,2 | 7,0 | 9,4 | 10,1 | 10,5 | 10,9 | 11 | 11,1 | 11,2 |
| 19 | 19,5 | 20 | 20,5 | 21 | 22 | 24 | 26 | 28 | 30 |
Représentons la courbe \(pH = f(Vb)\)
(Prendre 4 mm pour 1 mL en abscisse et 1 cm pour \(pH = 1\) en ordonnée).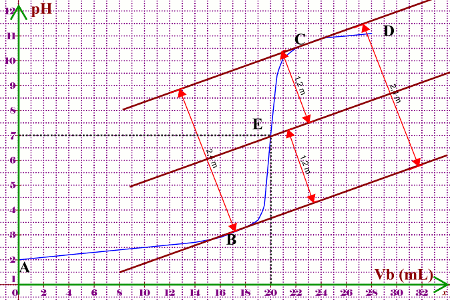 b) Analyse de la courbe \(pH = f(Vb)\).
b) Analyse de la courbe \(pH = f(Vb)\).
En observant cette courbe, on remarque qu’elle possède trois parties :
◊ La partie AB (\(Vb \prec 16\) mL) ou le pH croit très peu : La courbe est pratiquement linéaire.
◊ La partie BC ( \(18 \prec Vb \prec 16\) mL) qui correspond à une brusque augmentation du pH : C’est la zone du saut du pH. La courbe y présente un point d’inflexion ou point d’équivalence.
◊ La partie CD ( \(Vb \succ 22\) mL) ou le pH croit très peu, la courbe tend vers une asymptote horizontale.
c) Détermination graphique du point équivalent.
Le pont équivalent noté E est le point de la courbe pour lequel \(Vb = V{b_E}\). Il a pour coordonnées \(E(V{b_E},p{H_E})\) et peut être déterminé par trois méthodes :
La méthode des tangentes parallèles (méthode graphique ; voir graphe précédent)
La méthode de la courbe dérivée \(\frac{{dpH}}{{dVb}}\) (méthode numérique qui nécessite l’utilisation d’un tableur).
L’utilisation d’un indicateur coloré (changement de coloration).
Dans le cas du graphe précédent, la méthode des tangentes parallèles nous donne : \(E(V{b_E} = 20mL\) \(p{H_E} = 7)\)
A l’équivalence, on a \({n_{{H_3}{O^ + }}} = {n_{{}^ - OH}}\)
\(CaVa = \) \(CbV{b_E}\)
avec \(V{b_E}\) le volume de base équivalent.
La concentration d’acide est donc
\(Ca = \frac{{CbV{b_E}}}{{Va}}\)
Remarque :
Si nous dosons maintenant une solution de \(NaOH\) par une solution d’acide chlorydrique, le pH décroit puis varie brusquement et retrouve en fin une décroissance lente : On observe alors l’allure suivante de la courbe (exercices)
d) Application : Dosage colorimétrique.
- Activité expérimentale : Réaction entre une solution d’acide chlorhydrique et une solution d’hydroxyde de sodium.
• Objectif : Doser une solution d’acide chlorhydrique par une solution d’hydroxyde de sodium.
Matériels utilisées
2 micro-pipettes;
1 entonnoir;
1 tube en silicone;
1 micro support à 2 clips;
1 comboplate à godets;
1 micro spatule et 1 macro spatule;
1 micro-burette;
2 béchers pour prélever les solutions;
2 godets pour eau et poubelle;
Produits chimiques;
Solution de \(NaO{H_{aq}}\) à 0,1mol.L;
Solution de HCl aq à titrer;
Bleu de bromothymol;
Eau;
Consigne :
- En cas de contact de la peau avec l’acide ou la base, la rincer rapidement à l’eau
- Éviter de emettre le produit prélevé dans son flacon initial
- Rincer toujours le matériel avant son utilisation
A. Dispositifpérimental. B-Mode opératoire
B-Mode opératoire
1. Réaliser le montage (fixer le micro support dans le godet D2 et orienter les clips au dessus du godet F1).
2. Remplir la micro burette avec la solution de \(NaO{H_{aq}}\) jusqu’à la graduation 0,00mL et la fixer dans les clips.
3. Prélever à l’aide de la seringue 1,00 ml de la solution \(HC{l_{aq}}\) et l’introduire dans le godet F1. Faire de même pour les godets F4 et F6.
4. Ajouter une goutte de phénolphtaléine dans F1 et noter la couleur de la solution.
5. Verser progressivement la solution de soude de la micro burette dans la solution d’acide tout en homogénéisant à l’aide de la micro spatule, jusqu’à ce que la solution change de couleur.
6. Noter le volume V1 de \(NaO{H_{aq}}\) versé.
7. Remplir de nouveau la micro burette et reprendre les opérations 4 ; 5 et 6 en ayant pris soin de placer le micro support dans les godets D7 et D12. A l’approche du volume V1, laisser tomber la solution de soude goutte à goutte et relever alors les volumes V2 et V3.
Nettoyer le matériel et l’assécher.
C-Interprétation des observations.
1. Pourquoi la solution change-t-elle de couleur lorsqu’on verse un volume approprié de solution de soude ?
2. Écrire l’équation bilan de la réaction qui s’est produite dans les godets.
3. 3. Calculer \(Vb = \frac{{{V_1} + {V_2}}}{2}\) le volume moyen de la solution de soude versée Vb = ………….
4. A partir de l’équation chimique, déterminer la concentration Ca de la solution d’acide chlorhydrique.
\({n_{{H_3}{O^ + }}} = {n_{{}^ - OH}}\)
\(CaVa = \) \(CbVb\)
\(Ca = \frac{{CbVb}}{{Va}}\)
AN) Ca = …………… Ca = ………….±0,01mol/L.
Nous avons ainsi réalisé le dosage de notre solution d’acide chlorhydrique par la solution de soude.
3. Réaction acide faible-base forte : Cas d’une solution d’acide éthanoïque et d’hydroxyde de sodium.
3.1 Équation de la réaction et ses caractéristiques.
L’équation bilant de la réaction s’écrit :
\(C{H_3}COOH\) \( + {}^ - OH\) \( \to \) \(C{H_3}CO{O^ - }\) \( + {H_2}O\)
Cette réaction réversible est exothermique et quasi-totale (presque totale) dans le sens de la droite vers la gauche.
L’équation bilan globale de la réaction s’écrit :
\(C{H_3}COOH + \) \((N{a^ + } + {}^ - OH)\) \( \to \) \((C{H_3}CO{O^ - }\) \( + N{a^ + })\) \( + {H_2}O\)
On obtient une solution aqueuse d’acétate de sodium.
3.2 Dispositif expérimental.
Il est le même que celui de la figure 1, la solution \(HC{l_{aq}}\) étant remplacé par celle de l’acide éthanoïque.
3.3 Courbe de pH.
a) Tracé de la courbe \(pH = f(Vb)\)
A l’aide du dispositif expérimental de la figure 1, on réalise le dosage pH métrique de l’acide éthanoïque (Va = 20mL) par une solution de soude.
Les résultats expérimentaux sont consignés dans le tableau suivant :
| pH | 3,4 | 3,9 | 4,2 | 4,4 | 4,6 | 4,8 | 5 | 5,2 | 5,4 | 5,7 |
| Vb (mL) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 5,9 | 6,1 | 6,4 | 8,3 | 10,3 | 10,7 | 10,9 | 11 | 11,3 | 11,5 |
| 18,5 | 19 | 19,5 | 20 | 20,5 | 21 | 21,5 | 22 | 24 | 26 |
Représenter la courbe \(pH = f(Vb)\) (prendre 1cm pour 5mL en abscisse et 1cm pour \(pH = 1\) en ordonnées)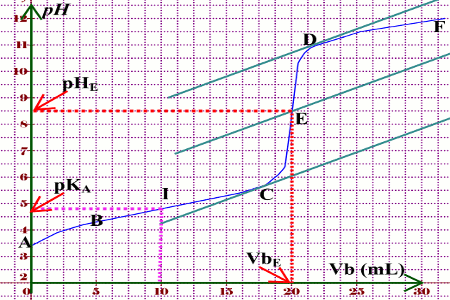 b) Analyse de la courbe \(pH = f(Vb)\)
b) Analyse de la courbe \(pH = f(Vb)\)
Elle présente 4 parties bien distinctes :
Ξ Partie AB : \(0 \le Vb \le 6\) mL ;On observe une variation du pH assez marquée.
Ξ Partie BC : \(6 \le Vb \le 18\) mL, Le pH varie lentement, la courbe est assimilable ici à une droite. Elle présente un point d’inflexion.
Ξ Partie CD : \(18 \le Vb \le 22\) mL ; On observe un saut brusque du pH, moins marqué que pour l’acide fort et présentant un second point d’inflexion.
Ξ Partie DF : \(Vb \le 22\) mL ; Le pH varie très peu et la courbe tend vers une asymptote horizontale.
La courbe présente deux point d’inflexion : Le point d’équivalence E et le point de demi-équivalence I.
• Point d’équivalence E.
Le second point d’inflexion noté E est le point d’équivalence. Il est déterminé par la méthode des tangentes.
On trouve à l’équivalence pH = 8,5 et \(V{b_E} = 20\) mL.
Sachant que l’équivalence est obtenue lorsque le mélange des réactifs, atteint les proportions stœchiométriques, c’est-à-dire quand la quantité d’ions \({}^ - OH\) versés est égale à la quantité d’acide initialement présent dans la solution.
\({n_{{}^ - OH}} = {n_{C{H_3}COOH}}\)
\(CbV{b_E} = CaVa\)
ou \(V{b_E}\) est le volume de base verse à l’équivalence.
La solution obtenue à un pH basique (pH>7).
• Point de demi-équivalence I.
Il correspond à un volume \(Vb = \frac{{V{b_E}}}{2}\) et à un pH = 4,8.
« A la demi-équivalence, la moitié de la quantité d’acide éthanoïque introduite a réagit, produisant alors une quantité égale d’ion éthanoate ».
soit, \([C{H_3}COOH]\) \( = [C{H_3}CO{O^ - }]\)
L’équation de la réaction qui se produit étant
\(C{H_3}COOH + \) \({}^ - OH\) \( \to \) \(C{H_3}CO{O^ - }\) \( + {H_2}O\)
déterminons le pKa du couple \(C{H_3}COOH/C{H_3}CO{O^ - }\)
\(Ka = \) \(\frac{{[C{H_3}CO{O^ - }][{H_3}{O^ + }]}}{{[C{H_3}COOH]}}\)
car à la demi-équivalence \([C{H_3}COOH]\) \( = [C{H_3}CO{O^ - }]\) \( = [{H_3}{O^ + }]\)
De plus \(pKa = \) \( - \log Ka\) \( = - \) \(\log [{H_3}{O^ + }]\) \( = pH\)
Donc à la demi-équivalence, pKa = pH correspondant à la demi-équivalence.
\(pK{a_{(C{H_3}COOH/C{H_3}CO{O^ - }\;)}}\) \( = 4,8\)
Conclusion :
Au cours de la réaction d’un acide faible sur une base forte, on a :
♣ \(p{H_I} = pKa\) du couple contenant l’acide faible.
♣ \(p{H_E} \succ 7\), l’équivalence se situe dans un milieu basique.
c) Application au dosage et choix de l’indicateur.
Le principe restant le même que précédemment, l’utilisation d’un indicateur coloré approprié en dosage colorimétrique permet de repérer le point d’équivalence.
La relation quantitative restant toujours \(CbV{b_E} = \) \(CaVa\)
Dans ce cas, l’indicateur approprié est la phénolphtaléine car sa zone de virage (8,0 - 10) contient le pH = 8,3 du point équivalent.
Le BBT peut être utilisé pour ce dosage avec des erreurs négligeables.
4. Réaction acide fort- base faible : Cas de la solution d’acide chlorhydrique et de l’ammoniac.
4.1 Équation de la réaction et caractéristiques.
L’équation bilan de la réaction s’écrit :
\({H_3}{O^ + } + \) \(N{H_3}\) \( \to \) \(NH_4^ + + \) \({H_2}O\)
La réaction est réversible, exothermique et il ya formation d’une solution aqueuse de chlorure d’ammonium suivant l’équation bilan globale :
\(({H_3}{O^ + } + C{l^ - })\) \( + N{H_3}\) \( \to \) \((NH_4^ + + C{l^ - })\) \( + {H_2}O\)
4.2 Dispositif expérimental.
Il est le même que celui de la fig.1, la solution de \(HC{l_{aq}}\) étant dans la burette et la solution d’ammoniac dans le bécher.
4.3 Courbe de pH
4.3.a) Tracé de la courbe pH = f(Va).
A l’aide du dispositif expérimental précédent, on suit l’évolution du pH de la solution d’ammoniac de concentration \(Cb = 1,0\) mol/L et de volume \(Vb = 20\) mL. Lorsqu’on y ajoute une solution d’acide chlorhydrique de même concentration les résultats expérimentaux sont consignés dans le tableau ci-dessous :
| pH | 10,7 | 10,3 | 9,9 | 9,6 | 9,4 | 9,2 | 9 | 8,7 | 8,3 | 7,8 |
| Va (mL) | 0 | 1 | 3 | 5 | 7 | 10 | 12 | 15 | 17 | 19 |
| 7,3 | 5,1 | 3,7 | 3,3 | 3,1 | 3 | 2,9 | 2,8 |
| 19,5 | 20 | 20,5 | 21 | 23 | 25 | 27 | 30 |
Représenter la courbe pH = f(Va) (prendre 1 cm pour 5 ml en abscisse et 1 cm pour pH = 1 en ordonnée)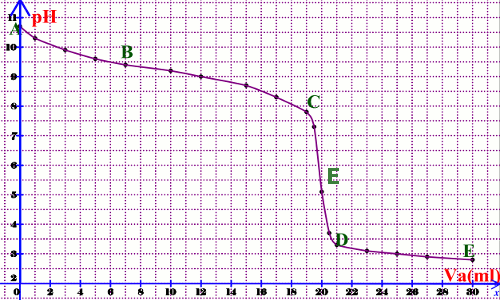 b) Analyse de la courbe.
b) Analyse de la courbe.
Elle est décroissante et présente 4 parties bien distinctes :
Ξ Partie AB : \(0 \le Va\) \( \le 7\) ml, le pH décroit rapidement sur un petit intervalle.
Ξ Partie BC : \(7 \le Va\) \( \le 19\) ml, on observe une variation lente du pH et la courbe présente un premier point d’inflexion noté I.
Ξ Partie CD : \(19 \le Va\) \( \le 21\) ml, on observe un saut brusque du pH présentant un second point d’inflexion E.
Ξ Partie DF ; \(Va \succ 21\) mL, le pH varie très peu et la courbe tend vers une asymptote horizontale.
• Point d’équivalence E
Par la méthode des tangentes on trouve pH = 5,1 et \(V{a_E} = 20\) mL.
Sachant que l’équivalence est obtenue lorsque le mélange des réactifs atteint les proportions stœchiométriques, c’est-à-dire quand
\({n_{{H_3}{O^ + }}}({\mathop{\rm int}} )\) \( = {n_{N{H_3}}}(t)\) \( \Rightarrow \) \(CaV{a_E}\) \( = CbVb\),
ou \(V{a_E}\) est le volume d’acide versé à l’équivalence.
A l’équivalence, la solution obtenu à un \(pH = 5,1\) \( \prec 7\), elle est donc acide.
• Point de demi-équivalence I
Il correspond à \(Va = \frac{{V{a_E}}}{2}\) de l’acide versé et à un \(pH = 9,2\).
Nous pouvons donc déterminer le pKa du couple \(NH_4^ + /N{H_3}\)qui est égal à 9,2.
Conclusion : Au cours de la réaction d’un acide fort sur une base faible, on a :
\(pH = pKa\) du couple contenant la base faible.
\(p{H_E} \prec 7\), l’équivalence E se situe en milieu acide.
b) Application au dosage.
Le principe restant le même que précédemment, l’utilisation d’un indicateur coloré approprié en dosage colorimétrique permet de repérer le point d’équivalence. La relation quantitative restant toujours \(CaV{a_E}\) \( = CbVb\),
Dans ce cas, l’indicateur approprié est le rouge de méthyle car sa zone de virage entre (4,2- 6,2) contient le pH = 5,1 du point équivalent. Il passe de la couleur rouge à la couleur jaune.
5. Les solutions tampons
5.1 Définition
Une solution tampon est une solution dont le pH varie très peu lorsqu’on ajoute des petites quantités (addition modérée) d’acide, de base ou d’eau. C’est aussi une solution constitué d’un acide faible et de sa base conjugué, de concentrations voisines.
Dans le dosage acide fort base faible ou acide faible base forte, les solutions obtenues à la demi-équivalence sont des solutions tampons.
Le pH d’une solution tampon est égale au pKa du couple acide /base.
5.2 Préparation d’une solution tampon.
• Principe : Mélange équimolaire d’un acide et sa base conjuguée.
• Méthode : 3 méthodes sont généralement utilisées :
a) Dosage d’un acide faible par une base forte jusqu'à la demi-équivalence.
b) Dosage d’une base faible par un acide fort jusqu’à la demi-équivalence.
c) Mélange d’une solution d’acide faible et d’une solution de sa base conjuguée, en quantités équimolaires.
5.3 Importance de l’effet tampon.
Les solutions tampons permettent de maintenir constant le pH du milieu ou elles ont introduites exemples :
Les solutions tampons de bicarbonate et de phosphate contribuent à fixer le pH du sang (La valeur normale se situe entre 7,35 et 7,45, ce qui correspond à une concentration en hydrogène de 45 à 55 nanomol / Litre.)
- Les produits pharmaceutiques sont tamponnés pour optimiser leur action ou pour réduire leurs effets secondaires indésirables.
- Les eaux minérales vendues sont tamponnées pour maintenir le pH = 7.


