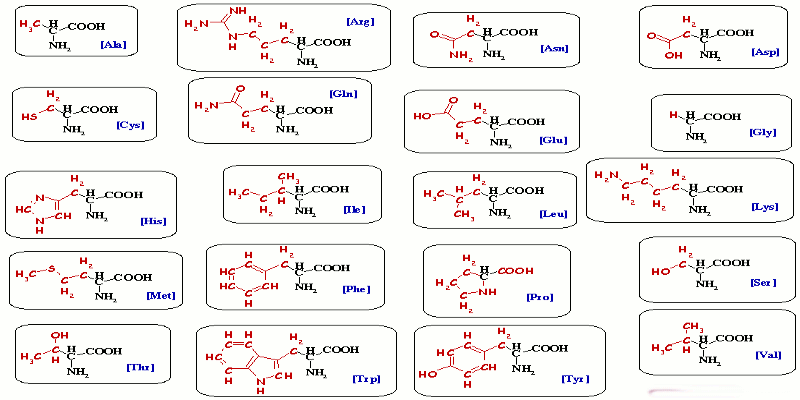
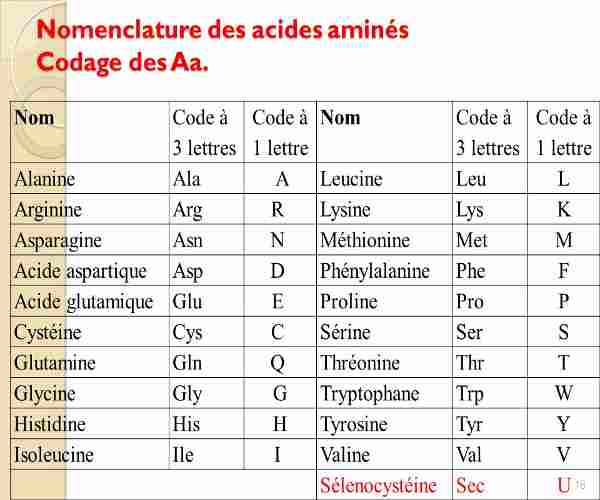
1-Définition
Un acide aminé ou amino-acide est un composé organique possédant à la fois une fonction acide carboxylique \( - C{O_2}H\) et une fonction aminé \( - N{H_2}\).
Un acide \(\alpha \)-aminé est un acide carboxylique dans lequel le groupe amino est porté par l’atome de carbone en Ç du groupe carboxyle.
La formule générale des acides α-aminés naturels est :
\(\begin{array}{*{20}{c}}{}&H&{}\\{}&|&{}\\{R - }&C&{ - COOH}\\{}&|&{}\\{}&{N{H_2}}&{}\end{array}\)
Où R peut être un atome d’hydrogène, un groupe alkyle linéaire
Ou ramifié, un groupe contenant un atome de soufre, un noyau aromatique ou d’autres fonctions chimiques tel alcool, amide, acide carboxylique : ce sont des composés polyfonctionnels.
La formule générale des acides α-aminés aliphatiques est : \({C_n}{H_{2n + 1}}O\)
La décarboxylation d’un acide α-aminés conduit à une amine primaire suivant l’équation-bilan :
\(R - \) \(CH(N{H_2})\) \( - COOH\) \( \to \) \(R - \) \(C{H_2} - \) \(N{H_2} + \) \(C{O_2}\)
2-Nomenclature
Les acides \(\alpha \)-aminés sont nommés comme les dérivés substitués des acides carboxyliques.
Exemples : \({H_2}N - \) \(C{H_2} - \) \(COOH\) : acide aminoéthnaoïque
\(C{H_3} - \) \(CH(C{H_3}) - \) \(C{H_2} - \) \(CH(N{H_2}) - \) \(COOH\) : acide 2-amino-4-méthylpentanoïque
Ils sont en général désignés par des noms courants employés en biochimie et des abréviations à trois lettres. Exemples : \(C{H_3} - \) \(CH(N{H_2})\) \( - COOH\): alanine : Ala,
\(C{H_3} - \) \(CH(C{H_3}) - \) \(CH(N{H_2})\) \( - COOH\) : valine: Val
3-Chiralité des molécules
3-1-Le carbone asymétrique et la chiralité
C’est un atome de carbone tétragonal lié à quatre atomes ou groupe d’atomes différents.
Toutes les molécules d’acides α-aminés sont chirales à l’exception de la glycine.
La chiralité est la propriété d’un objet ou d’une molécule de ne pas être superposable à son image dans un miroir plan. La chiralité d’une molécule est due à la présence d’un atome de carbone asymétrique. Exemples de molécule chirale.
\(\begin{array}{*{20}{c}}{}&{N{H_2}}&{}\\{}&|&{}\\{C{H_3} - }&{\mathop C\limits^* H}&{ - COOH}\end{array}\)
L’atome de carbone asymétrique est marqué par l’astérisque.
Les stéréo-isomères sont les formes spatiales différentes d’une même molécule.
Les énantiomères sont des isomères de configuration dont les images sont non superposables l’une de l’autre dans un miroir plan.
La représentation spatiale de deux énantiomères de l’alanine: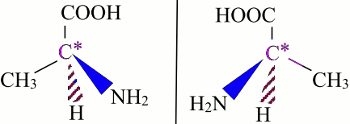 C’est la propriété d’une substance chirale de faire tourner d’un angle α le plan de polarisation de la lumière polarisée qui la traverse.
C’est la propriété d’une substance chirale de faire tourner d’un angle α le plan de polarisation de la lumière polarisée qui la traverse.
Le dispositif expérimental de l’étude de l’activité optique d’une substance chirale comprend :
- Une source de lumière naturelle
- Un polariseur ou polaroïd ou filtre polarisant.
- Un analyseur Une substance est optiquement active ou douée d’un pouvoir rotatoire lorsqu’elle fait tourner le plan de polarisation de la lumière polarisée.
Une substance dextrogyre est celle qui fait tourner le plan de polarisation de la lumière polarisée dans le sens des aiguilles d’une montre.
Une substance lévogyre est celle qui fait tourner le plan de polarisation de la lumière polarisée dans le sens contraire des aiguilles d’une montre.
Les acides \(\alpha \)-aminés à l’exception de la glycine sont des molécules chirales et optiquement active dont l’un des énantiomères est dextrogyre et l’autre dextrogyre.
Un mélange racémique est un mélange équimolaire de deux énantiomères. Il est optiquement inactif.
4-Représentation de Fisher.
C’est la représentation simple des atomes de carbone tétraédriques :
- L’atome de carbone considéré est l’atome de carbone en \(\alpha \).
- On place cet atome dans le plan de la feuille, la liaison \(\mathop C\limits^* - COOH\) étant placée verticalement, en haut et vers l’arrière, la liaison \(\mathop C\limits^* - R\) étant placée verticalement, en bas et vers l’arrière.
- On projette alors les quatre liaisons dans le plan de la figure ; on allège au maximum la représentation en ne faisant pas figurer l’atome de carbone central.
L’atome de carbone asymétrique en α d’un acide α-aminé est :
- De configuration D, si le groupe \( - N{H_2}\) figure à droite dans la représentation de Fisher
- De configuration L, si le groupe \( - N{H_2}\) figure à gauche dans la représentation de Fisher
Exemple de la représentation de Fisher de l’alanine avec les configurations :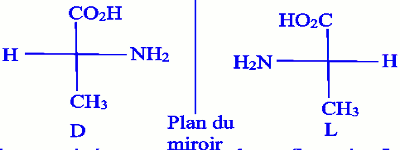 NB : Tous les acides α-aminés naturels sont de configuration L. Les configurations L et D n’ont rien à voir avec lévogyre et dextrogyre.
NB : Tous les acides α-aminés naturels sont de configuration L. Les configurations L et D n’ont rien à voir avec lévogyre et dextrogyre.
5-Les propriétés acido-basiques.
Le zwittérion ou Amphion est un ion dipolaire électriquement obtenu par transfert intramoléculaire d’u proton \({H^ + }\) du groupe carboxyle vers le groupe amine.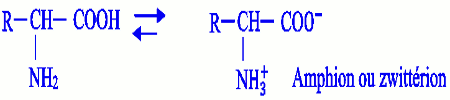 A l’état pur, les acides \(\alpha \)-aminés existent sous forme d’amphion.
A l’état pur, les acides \(\alpha \)-aminés existent sous forme d’amphion.
Au point de vue acido-basique, l’amphion peut être considéré :
- Soit comme une base susceptible de capter un proton \({H^ + }\) : Le cation est majoritaire en milieu acide (\({P^H} \prec 1,5\))
Le cation est majoritaire en milieu acide (\({P^H} \prec 1,5\))
- Soit comme un acide susceptible de céder un proton \({H^ + }\) L’amphion est un ampholyte ou amphotère car se comporte tantôt comme un acide tantôt comme une base.
L’amphion est un ampholyte ou amphotère car se comporte tantôt comme un acide tantôt comme une base.
L’anion est majoritaire en milieu basique ( \({P^H} \succ 1,1\) )
NB : Pour des pH intermédiaires (\(3,5 \prec \) \({P^H}\) \( \succ 8,5\)) l’acide α-aminé existe principalement sous la forme d’un amphion.
6- La liaison peptidique
6-1- Définition.
C’est la liaison qui se forme par élimination d’une molécule d’eau entre le groupe amino d’une molécule d’acide α-aminé et le groupe carboxyle d’une autre molécule d’acide α-aminé. Sa configuration est trans.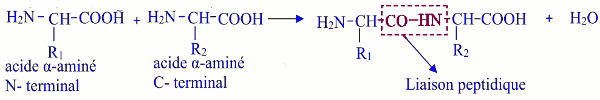 La liaison peptidique est le groupe :
La liaison peptidique est le groupe :
\(\begin{array}{*{20}{c}}{}&O&{}&H&{}\\{}&{||}&{}&|&{}\\ - &C& - &N& - \end{array}\)
6-2-Peptides et protéines
Un dipeptide résulte de la formation d’une liaison peptidique entre deux molécules d’acide α-aminé. Les peptides sont des polypeptides de masse molaire inférieure à 5000g/mol alors que les protéines sont des polypeptides de masse molaire supérieure à 5000g/mol
6-3-Réaction entre deux acides α-aminés.
Lorsqu’on effectue un mélange équimolaire de deux acides \(\alpha \)-aminés tels que la glycine(Gly) et l’alanine(Ala), on obtient quatre dipeptides différents : Gly-Gly, Gly-Ala, Ala-Ala et Ala-Gly. Il est à noter que des tripeptides et tétrapeptides peuvent aussi se former. La réaction conduisant à Ala-Gly est la suivante :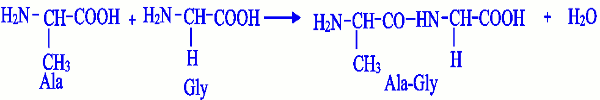 NB : Pour nommer un dipeptide, on utilise l’abréviation à trois lettres des acides aminés en commençant par l’acide α-aminé dont le groupe amino est libre (acide α-aminé N-terminal), le symbole de chaque acide α-aminé étant séparé de l’autre par un tiret.
NB : Pour nommer un dipeptide, on utilise l’abréviation à trois lettres des acides aminés en commençant par l’acide α-aminé dont le groupe amino est libre (acide α-aminé N-terminal), le symbole de chaque acide α-aminé étant séparé de l’autre par un tiret.
6-4-La synthèse sélective d’un dipeptide
On procède par activation des groupes qui réagissent pour former la liaison peptidique et blocage des fonctions qui n’interviennent pas. On procède ainsi :
- Blocage de la fonction amine de l’acide aminé N-terminal en en la transformant en amide.
- Activation de la fonction acide carboxylique de l’acide aminé N-terminal en la transformant en chlorure d’acyle
- Blocage de la fonction acide carboxylique de l’acide aminé C-terminal en la transformant en ester.
- Mélange pour réaction des deux acides \(\alpha \)-aminés.
- Régénération des fonctions protégées.
Lorsqu’on fait réagir un mélange racémique de valine sur un mélange racémique de l’alanine dans des conditions telles que le dipeptide Ala-Val puisse se former, on obtient un mélange de quatre stéréo-isomères : Ala(D)-Val(D) ; Ala(D)-Val(L) ; Ala(L)-Val(D) et Ala(L)-Val(L)